
可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应:
①Br2 + 2e- = 2Br- ②2Br- - 2e- = Br2 ③Zn – 2e- = Zn2+ ④Zn2+ + 2e- = Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是
A.④和① B.②和① C.③和① D.②和③
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014届山东省文登市高三上学期期中统考理综化学试卷(A)(解析版) 题型:填空题
氧化还原反应规律是化学学科的重要规律之一。按要求回答下列问题:
(1) 被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,此反应中B元素的化合价没有发生变化,则NaBH4中H的化合价为___________,该反应氧化产物是______________,还原产物是______________。
(2) 有下列三个反应:
①Cl2+FeI2=FeCl2+I2 ;②2Fe2++Br2=2Fe3++2Br-;③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
①根据以上方程式可以得到Fe2+、Co2+、Br-、I-还原性由强的弱的顺序为_________;
②1molCo2O3能氧化HCl的物质的量_____________。
(3) 完成并配平下列化学反应方程式:
□KMnO4+□H2C2O4+□________ □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O
(4)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2H+ +Zn=Zn2++H2↑,可拆写为氧化反应式:Zn-2e-=Zn 2+,还原反应式:2H++ 2e-=H2↑。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
①将2Fe3++Cu= 2Fe2+ +Cu2+拆写为两个“半反应式”:其中,氧化反应式为 。
②由①中的反应,可设计成如右图所示的原电池:
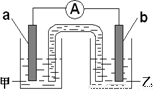
若电极a为Cu ,电解质溶液甲的化学式为 ;
电极b处的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com