
| A、pH=0的溶液:CH3COO-、NO3-、SO42-、I- |
| B、c(H+)=10-14mol/L的溶液中:Na+、AlO2-、S2-、SO32- |
| C、酸性环境下:Na+、Cu2+、NO3-、SO42- |
| D、pH=7的溶液中:K+、Na+、Fe3+、SO42- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Ag |
| B、Zn(OH)2 |
| C、Ag2O |
| D、Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同 |
| B、乙烯和1,3-丁二烯互为同系物,它们均能使Br2水褪色 |
| C、用新制氢氧化铜悬浊液可以鉴别乙酸、乙醛和乙醇三种液体 |
| D、乙酸乙酯中含有的杂质乙酸可用NaOH溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH3-CH3+Br2
| |||
B、2CH3CHO+O2
| |||
| C、CH3-CH═CH2+Br2→CH3-CHBr-CH2Br | |||
D、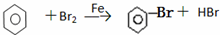 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为摇摆电池的工作原理图,在充放电过程中Li+在两极间“摇来摇去”,其总反应为:LiCoO2+6C
如图为摇摆电池的工作原理图,在充放电过程中Li+在两极间“摇来摇去”,其总反应为:LiCoO2+6C | 充电 |
| 放电 |
| A、放电时,负极反应为:LiCoO2-═Li(1-x)CoO2+xLi+ |
| B、充电时,B极发生还原反应 |
| C、充电时,Li+穿过隔离膜向B极移动 |
| D、当A极得到x mol电子,电池消耗6 mol C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类、蛋白质是高分子化合物,适当的条件下可以发生水解反应 |
| B、甲烷和氯气光照条件下发生取代反应,产物是气体与液体混合物 |
| C、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
| D、乙醇与乙酸不能混合,因为二者可以马上生成乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 | ||
| A | 其单质是密度最小的物质 | ||
| B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 | ||
| C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的
| ||
| D | 其氢氧化物和氧化物都有两性,且与C同周期 | ||
| E | 与C同周期,其原子半径在该周期最小 | ||
| R | 有多种化合价,其最高正价为+6价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 城市 | 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 甲 | 55 | SO2 | Ⅱ | 良 |
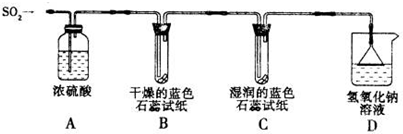
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com