
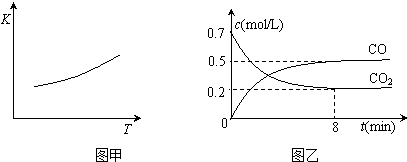
| △c |
| △t |
| 3.36L |
| 22.4L/mol |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| 0.5mol/L |
| 8min |


 口算小状元口算速算天天练系列答案
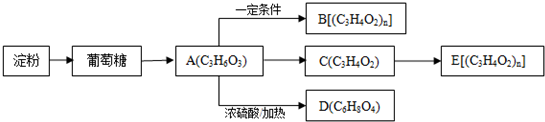
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
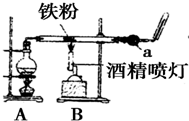 如图是铁与水蒸气反应的实验装置.某同学在硬质玻璃管中放入足量还原性铁粉和少量石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,进行高温下铁与水蒸气反应的实验.请回答下列问题:
如图是铁与水蒸气反应的实验装置.某同学在硬质玻璃管中放入足量还原性铁粉和少量石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,进行高温下铁与水蒸气反应的实验.请回答下列问题:| 操作 | 现象 | 结论 | 解释(用离子方 程式表示) |
| 将反应后的固体全部取出置于烧杯中,加入足量的盐酸,溶解后过滤,立即向滤液中滴加KSCN溶液,观察溶液的颜色. | 滴加KSCN溶液后,溶液不变红色 | ① ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=12的溶液中:K+,Na+,AlO2-,S2-,SO32- |
| B、无色溶液中:K+,Cl-,MnO4-,PO43-,SO42- |
| C、水电离的H+浓度C(H+)=10-12mol?L-1的溶液中:ClO-,SO42-,NO3-,NH4+,Na+ |
| D、某强酸性溶液中:Fe2+,Al3+,NO3-,I-,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
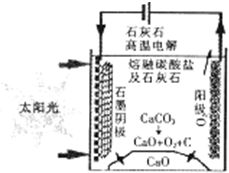 按要求回答:
按要求回答:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com