
常温下,0.1 mol·L-1的一元酸HA与0.1 mol·L-1的NaOH溶液等体积混合后,所得溶液pH>7, 下列说法正确的是
A.混合前一元酸HA的c(H+)=0.1 mol·L-1
B.该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
C.HA在水溶液中的电离方程式:HA = H+ + A-
D.该混合溶液中:c(A-)+ c(HA)=0.1 mol·L-1
科目:高中化学 来源:2014秋季甘肃省高二第一学期期中考试文科化学试卷(解析版) 题型:选择题
下列物质中,属于目前世界上用量最大、用途最广的合金是
A.青铜 B.钢材 C.18K金 D.钛合金
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市十校高三10月联考化学试卷(解析版) 题型:填空题
(16分)在一定条件下,NO与NO2混合可生成N2O3 ,反应的化学方程式为:
NO(g)+NO2(g) N2O3(l) △H<0
N2O3(l) △H<0
下图表示一定量的NO、NO2混合气体发生反应时,N02浓度在前25s内的变化。该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L。

(1)前20s内,NO2的平均反应速率为_________________。
(2)其他条件不变,①升高温度,NO2的转化率_______ (填“增大”、“减小”或“不变”)。
②压缩气体体积,该反应平衡向______ _移动(填“正向”或“逆向”)。
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线。
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线。
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为:______,该反应的氧化剂是______________。
查看答案和解析>>
科目:高中化学 来源:2015届广东省肇庆市高三一模理综化学试卷(解析版) 题型:选择题
根据反应:S2O32-+2H+==SO2+S↓+H2O,下表各组实验最快出现浑浊的是
| Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | ||
c(mol·L-1) | V(mL) | c(mol·L-1) | V(mL) | V(mL) | ||
A | 0.1 | 5 | 0.1 | 5 | 5 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市毕业班调研测试理综化学试卷(解析版) 题型:填空题
(16分)(1)乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:甲醇脱水反应①2CH3OH(g) = CH3OCH3(g)+H2O(g)?△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g) = C2H4 (g)+2H2O(g)?△H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g) = CH3OCH3(g))? △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g) C2H5OH(g) △H= ;
C2H5OH(g) △H= ;
(2)乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图。结合曲线归纳平衡转化率-T曲线变化规律:
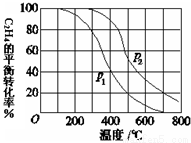
(a) ;
(b) ;
(3)若要进一步提高乙烯的转化率,可以采取的措施有 。
A.增大乙烯的浓度 B.分离出乙醇 C.加催化剂
(4)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)转化率为50%,求x的值。(写出计算步骤)
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:填空题
(16分)Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为 ;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式: 。
(2)请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
实验步骤 | 预期现象与结论 |
步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 |
; |
步骤2: ____________________________________ ____________________________________。 |
|
(3)利用(2)提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:
取少量样品溶于水, 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
下列分离、提纯、鉴别物质的方法正确的是
A. 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
B. 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C. 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D. 用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高一第一学期期中考试化学试卷(解析版) 题型:选择题
小明家中有如下生活用品:碘酒、食盐、食醋、84消毒液(有效成分为NaClO),小明利用上述用品不能完成的任务是
A.检验买来的奶粉中是否加有淀粉
B.检验自来水中是否含有Cl-
C.除去保温瓶中的水垢
D.洗去白色衣服上的番茄汁
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:填空题
某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示:

(1)碱浸时为提高铝土矿的浸出率可采取的措施是 , 。(答两点)
(2)AlO(OH)与NaOH反应的化学方程式为 。
(3)在稀释、结晶过程中,加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的某气体的方法来代替。通入气体时发生反应的离子方程式是 .
(4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式: 。
(5)该生产流程能实现 (填化学式)的循环利用。
(6)氧化铝是工业上冶炼铝的原料,用氧化铝电解制备金属铝时需加入冰晶石(Na3AlF6)作助熔剂,写出用NaF和Al2(SO4)3反应制备冰晶石的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com