
(8分)胃酸(主要成分为盐酸)过多是常见的胃病。甲、乙两种中学课本中用以治疗胃酸过多的常见胃药,以下是它们的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;
(2)能溶于水,水溶液呈弱碱性;
(3)遇酸及酸性药物则产生二氧化碳;
乙:(1)与胃酸是中和作用缓慢而持久,可维持3~4小时。
(2)凝胶本身覆盖于溃疡面上,具有保护作用。
(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是 (填中文名称);乙中含有的主要化学成份是 (填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的化学方程式: 。
(3)试写出乙中含有的主要化学成份分别与稀盐酸和氢氧化钠溶液反应的离子方程式: ; 。
(1)甲 碳酸氢钠 (1分) ;乙 Al(OH)3 (1分)
(2) NaHCO3 + HCl = H2O +CO2↑+NaCl (2分)
(3) Al(OH)3 + 3H+ = Al3+ + 3H2O (2分)
Al(OH)3 + OH- = AlO2- + 2H2O (2分
【解析】
试题分析:甲,由(1)可知该物质热稳定性差,由(2)可知该物质为强碱弱酸盐,由(3)可知该物质能与酸反应生成二氧化碳,故应为碳酸氢钠;乙:(1)可知该物质水溶性较差,(2)可知该物质呈胶体状,(3)该物质为两性,故乙为氢氧化铝Al(OH)3;甲中含有的主要化学成份引起胃胀气反应是因为碳酸氢钠与稀盐酸反应产生了二氧化碳气体,化学方程式为:NaHCO3 + HCl = H2O +CO2↑+NaCl;氢氧化铝两性,可与盐酸反应:Al(OH)3 + 3H+ = Al3+ + 3H2O,也可与氢氧化钠反应:Al(OH)3 + OH- = AlO2- + 2H2O。
考点:元素化合物知识。


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
对同温同压下的两种气体 和
和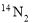 的有关比较正确的是
的有关比较正确的是
A.质量相等时所含质子数相等 B.体积不相等时密度有可能相等
C.体积相等时所含电子数相等 D.原子数相等时所含中子数相等
查看答案和解析>>
科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:填空题
(8分)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)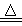 MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
(1)写出该反应的离子反应方程式_____________________________________。
(2)参加反应的二氧化锰的质量为____________。
(3)反应中被氧化的HCl的物质的量为 ____________。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g·cm-3,为使用方便,请计算出该浓盐酸
的物质的量浓度______________。
查看答案和解析>>
科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:选择题
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是
A.Mg B.Cu C.Ag D.H2
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一1月月考化学试卷(解析版) 题型:计算题
(6分)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有白色沉淀生成,在所得的悬浊液中逐滴加入1 mol·L-1HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示。

试回答:
(1)从0开始到A点沉淀物的化学式为 ;B点沉淀物的化学式为 。
(2)原混合物中的MgCl2的物质的量为 ,AlCl3的物质的量为 ,NaOH的物质的量为 。
(3)HCl溶液在C点的体积数是 mL。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一1月月考化学试卷(解析版) 题型:选择题
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的是
A.样品中含有少量Na2O杂质
B.容量瓶中原来有少量蒸馏水
C.定容时观察液面仰视
D.未冷却至室温直接把NaOH溶液移入容量瓶中
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一1月月考化学试卷(解析版) 题型:选择题
把过氧化钠投入含有HCO3-、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是
A.HCO3- B.Cl- C.Mg2+ D.Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二1月月考化学试卷(解析版) 题型:选择题
已知mX(g)+nY(g) gZ(g)的ΔH<0,在恒容密闭容器中反应达到平衡时,下列说法正确的是
gZ(g)的ΔH<0,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.升高温度,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省平度市高二上学期期中考试化学试卷(解析版) 题型:填空题
(14分)现有反应:mA(g)+ B(g) 2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H 0(填“>”或“<”),且m 1(填“>”“=”“<”)。
(2)若加入B(假设容器的体积不变),则A的转化率 ,B的转化率 。(填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色 ,
若维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”)。
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如下图所示。

则0~2 min内的平均反应速率υ(C)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com