
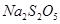 )常用作食品漂白剂,其制备工艺流程如下:
)常用作食品漂白剂,其制备工艺流程如下: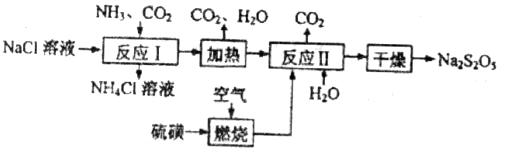
 等多步反应。
等多步反应。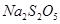 与稀硫酸反应放出
与稀硫酸反应放出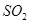 ,其离子方程式为___________。
,其离子方程式为___________。 Na2S2O5+H2O,参加反应的气体与固体的物质的量之比接近2:1,若气体量不足,则会导致Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低。(4)Na2S2O5与稀硫酸反应放出SO2,其离子方程式为S2O52—+2H+=2SO2↑+H2O。
Na2S2O5+H2O,参加反应的气体与固体的物质的量之比接近2:1,若气体量不足,则会导致Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低。(4)Na2S2O5与稀硫酸反应放出SO2,其离子方程式为S2O52—+2H+=2SO2↑+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸遇明火爆炸 |
| B.浓硫酸遇水发热爆炸 |
| C.铁与水(常温下)反应产生的氧化物爆炸 |
| D.稀释后的硫酸与铁反应产生的氢气在空气中遇明火而爆炸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.制取NaHCO3的反应是利用其溶解度小于NaCl |
| B.用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C.在第③、④、⑤步骤中,溴元素均被氧化 |
| D.工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2I-+S4O62-)
2I-+S4O62-)
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

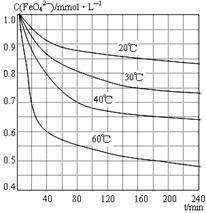
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
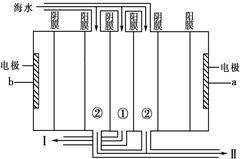
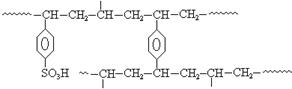
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
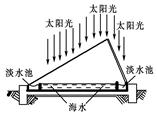
| A.利用太阳能,将海水蒸馏淡化 |
| B.加入明矾,使海水的盐份沉淀并淡化 |
| C.通直流电,采用电渗透法使海水淡化 |
| D.通过离子交换膜,除去所含的盐分使海水淡化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com