
| A. | 其他步骤正确,滴定达到终点时,俯视读数,测得c(H+)偏大 | |
| B. | 实验测得25℃时,HgI2的Ksp=4×10-9 | |
| C. | 一定温度下,向HgI2饱和溶液中加入少量Hg(NO3)2溶液,HgI2的Ksp减小 | |
| D. | 温度不变,在t时,向HgI2饱和溶液中加入少量浓KI溶液,离子浓度变化如图所示 |
分析 A.滴定实验中,滴定管的0刻度在上方,俯视时液面在刻度线的上方;
B.先根据用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL,测得氢离子物质的量为5×10-5mol,依据Hg2+(aq)+2R-H(s)=R2Hg(s)+2H+(aq),计算得到Hg2+物质的量=2.5×10-5mol;n(I-)=5×10-5mol,再依据Ksp=c(Hg2+)×c2(I-)来解答;
C.沉淀溶度积Ksp只与温度有关,与浓度无关;
D.依据溶度积为一定温度下的常数分析.
解答 解:A.滴定终点时俯视读数,导致测量值比实际消耗的标准液偏低,测定的H+浓度将偏低,故A错误;
B.用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL,测得氢离子物质的量为5×10-5mol,依据Hg2+(aq)+2R-H(s)=R2Hg(s)+2H+(aq),计算得到Hg2+物质的量=2.5×10-5mol;n(I-)=5×10-5mol;Ksp=c(Hg2+)×c2(I-)=$\frac{2.5×1{0}^{-5}}{0.025}$×($\frac{2.5×1{0}^{-5}}{0.025}$)2=4×10-9 ,故B正确;
C.在温度不变时,向HgI2饱和溶液中加入少量硝酸铅浓溶液,HgI2的Ksp不变,故C错误;
D.依据HgI2(s)?Hg2++2I-;温度不变,T时刻,向HgI2饱和溶液中加入少量KI浓溶液,平衡左移,平衡后溶液中碘离子浓度增大,铅离子浓度减小,故图象不正确,故D错误;
故选:B.
点评 本题考查了沉淀溶解平衡的移动和计算应用,溶度积常数的分析判断,溶液PH的计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
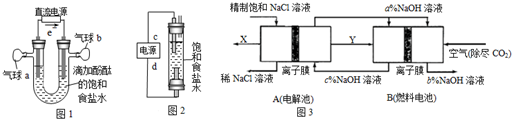
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
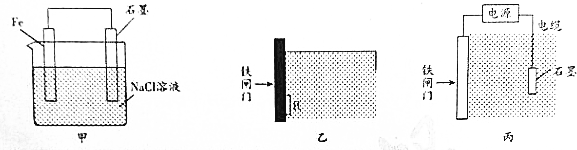
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1mo1K0H的溶液与1mo1CO2完全反应后,溶液中c(K+)>c(HCO3- ) | |
| B. | 0.2mo1/LCH3COOH溶液与0.1mo1/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| C. | 将100mL0.1mo1.L-1的醋酸稀释至pH=4:n(CH3COO-)+n(CH3COOH)=0.01mo1 | |
| D. | pH=5的NaHSO3溶液中:c(HSO3-)+c(SO32-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | pH=7 | pH=6 | pH=5 | pH=3 |
| 20℃ | 300 | 240 | 160 | 58 |
| 30℃ | 160 | 108 | 40 | 20 |
| 50℃ | 80 | 50 | x | 8 |
| A. | x可能为42 | |
| B. | 其他条件不变,在30°、pH=4下的反应速度比40℃、pH=6时快 | |
| C. | 根据单一变量法,无法比较温度、pH均不同的两组实验的反应速率较慢 | |
| D. | 30℃,pH=3条件下,KI的反应速率为v(KI)=0.005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
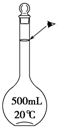 实验室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.1mol•L-1的NaCl溶液,有如下操作步骤:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 结合如表回答下列问题(均为25℃时的数据)
结合如表回答下列问题(均为25℃时的数据)| 酸 | 电力平衡常数(Ka) | 酸 | 电力平衡常数(Ka) |
| CH3COOH | 1.7×10-5 | H3BO3 | 5.8×10-10 |
| H2CO3 | Ka1=4.2×10-7 Ka2=5.6×10-11 | HNO2 | 7.1×10-4 |
| HCN | 6.2×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-的物质的量相同 | B. | H+ 物质的量相同 | ||
| C. | OH-的物质的量浓度不同 | D. | H+的物质的量浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液显碱性,可用热的纯碱溶液除去金属表面的油污 | |
| B. | 明矾溶于水可形成氢氧化铝胶体,可用于自来水的杀菌消毒 | |
| C. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| D. | 氢氧化铁的溶解度比氢氧化铜的小得多,可向硫酸铜溶液中加入氢氧化铁除去混有的Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com