
【题目】如图为实验室中浓硫酸试剂瓶标签上的部分内容,请回答问题。
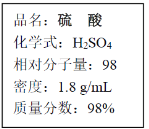
(1)该硫酸的物质的量浓度是________mol/L。
(2)某实验需要90mL3.0mol/L稀硫酸,配制该溶液,经计算,需要用量筒量取___mL浓硫酸。
(3)在下列配制过程示意图中,有错误的是(填写序号)________。

(4)下列情况会引起所配稀硫酸浓度偏高的是________。
A 用蒸馏水将量筒中残留的硫酸洗出合并 B 容量瓶洗涤后,未经干燥处理
C 溶液未能冷却就定容 D 未洗涤烧杯和玻璃棒
【答案】18 16.7 ①④ AC
【解析】
(1)根据c=![]() 带入数据进行计算;
带入数据进行计算;
(2)根据溶液稀释前后物质的量不变计算所需浓硫酸的体积,没有90mL的容量瓶,以100mL容量瓶计算;
(3)根据正确配制一定物质的量浓度的溶液操作步骤进行分析;
(4)根据c= ![]() 进行误差分析。
进行误差分析。
(1)根据c=![]() ,该浓硫酸的物质的量浓度为:c=
,该浓硫酸的物质的量浓度为:c=![]() mol·L-1=18.0mol·L-1。
mol·L-1=18.0mol·L-1。
(2)根据溶液稀释前后物质的量不变计算所需浓硫酸的体积,没有90mL的容量瓶,以100mL计算,设浓硫酸的体积为xmL,所以xmL×18.0mol·L-1=100mL×3mol·L-1,解得:x≈16.7;
(3)①应将浓硫酸倒入水;②引流操作正确;③用玻璃棒引流,操作正确;④读数时视线与凹液面最低处相切,故选①④。
(4)A、用蒸馏水将量筒中残留的硫酸洗出合并,取浓硫酸的体积增大,所配溶液浓度偏高,故A正确;
B、最后需要加水定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响,故B错误;
C、溶液有热胀冷缩的性质,浓硫酸稀释,放出大量的热,溶解后未恢复室温立即转移到容量瓶中定容,导致所配溶液体积减小,所配溶液浓度偏高,故C正确;
D、未洗涤烧杯和玻璃棒,移入容量瓶中的溶质硫酸的物质的量减小,所配溶液浓度偏低,故D错误;
故选AC。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知室温下BaSO4的Ksp =1.1×1010,欲使溶液中c(SO42-)≤1.0×106 mol·L1,应保持溶液中c(Ba2+)≥___________。
(2)向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应的离子方程式为_______________
(3)25℃时,有c(CH3COOH)+c(CH3COO-)= 0.1mol·L1的醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。

下列有关溶液中离子浓度关系的叙述正确的是_____________。(错选不得分)
A.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W 点所表示的溶液中:c(Na+)+c(H+)= c(CH3COOH)+c(OH-)
C.pH = 3.5的溶液中:c(Na+) +c(H+) c(OH-) +c(CH3COOH)= 0.1mol·L1
D.向W点所表示的1.0 L 溶液中通入0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)= c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 若单位时间内生成xmolNO的同时消耗xmolNH3,则反应达到平衡状态
B. 化学反应速率关系是:2v正(NH3)=3v正(H2O)
C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 达到化学平衡时,4v正(O2)=5v逆(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度的升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H_____0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为_____molL﹣1s﹣1。
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,经10s又达到平衡。T_____100℃(填“大于”或“小于”),判断理由是_____________。

(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_____(填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫代磷酸锌( ![]() )是一种表面活性剂,能够提高橡胶的抓着力、耐磨性。请回答下列问题:
)是一种表面活性剂,能够提高橡胶的抓着力、耐磨性。请回答下列问题:
(1)二硫代磷酸锌结构中,P的杂化方式为__________________,C1、P、S的第一电离能由大到小的顺序为_____________________。
(2)Zn2+的价层电子排布式为________________,锌能够跟强碱溶液反应生成[Zn(OH)4]2-,不考虑空间构型,[Zn(OH)4]2-的结构可用示意图表示为__________________。
(3)硫元素能形成多种含氧酸,两分子硫酸脱去一分子水生成焦硫酸(H2S2O7),则1mol焦硫酸中含有硫氧键的数目为____________;用价层电子互斥理论判断并解释SO32-与SO42-键角的相对大小。
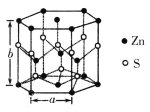
(4)纤锌矿的六方晶体结构如图所示,该晶胞的化学式为___________,其晶胞参数分别为a pm和b pm,则该晶体的密度为____________________g·cm-3(用含a、b、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
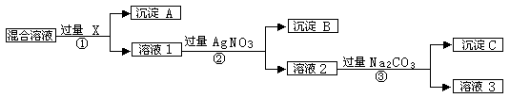
请回答下列问题:
⑴写出实验流程中下列物质的化学式: 试剂X : ,沉淀A:
⑵上述实验流程中加入过量的Na2CO3的目的是 。
⑶按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 ,之后若要获得固体NaNO3需进行的实验操作是 (填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法符合事实的是( )
A. 常温下由水电离产生的c(H+)=10-12mol/L的溶液中加入铝粉都能够产生氢气
B. 用0.2000 /L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和
C. 电解硫酸铜溶液一段时间后,加入氧化铜固体不可能使溶液恢复到原来的浓度
D. 在NaAlO2和Na2CO3的混合溶液中逐滴滴加盐酸直至过量,开始没有沉淀,随后产生沉淀,最后沉淀消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com