
【题目】取表面部分氧化的镁条8.00g溶于250mL4.00mol·L-1的稀盐酸中,向所得溶液中滴加未知浓度的NaOH溶液,产生沉淀的质量与NaOH溶液的体积关系如图所示:
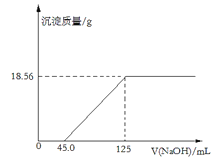
请计算:
(1)NaOH溶液的物质的量浓度___mol·L-1。
(2)样品中镁元素的质量___g。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】《必修1》中学习过:A过滤、B蒸发(结晶)、C蒸馏、D分液、E萃取、F配制一定物质的量浓度的溶液,根据所学的知识回答下列下列问题:
(1)选用适当的方法分离或提纯,应选用上述哪一种?(填序号)
①除去 NaCl 溶液中所含的少量 KNO3__________;
②从碘水中提取碘__________;
③用自来水制取蒸馏水__________;
④分离植物油和水__________;
(2)除过滤、蒸发(结晶)外还有_____实验用到了玻璃棒。需要加热的实验有蒸发(结晶)和__________;填序号)。
(3)图是硫酸试剂瓶标签上的内容。实验室用该硫酸配制240mL0.46mol/L的稀硫酸,则

a.需量取该硫酸的体积为__________mL;
b.有以下仪器:①烧杯 ②100mL量筒 ③250mL容量瓶④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)⑦10mL量筒⑧胶头滴管,配制过程中,必须使用的仪器是_____(填代号);
(4)该同学实际配制得到的浓度为0.47mol/L,可能的原因是_______________
A.量取浓H2SO4时仰视刻度 B.容量瓶洗净后未经干燥处理
C.没有将洗涤液转入容量瓶 D.定容时仰视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸烟有害健康,青少年应远离烟草。烟草和烟气中含有多种有害有毒物质,其中剧毒物尼古丁的结构简式如图乙所示,致癌物质苯并吡的结构如图甲所示,有关其叙述正确的是
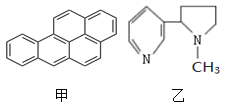
A. 尼古丁属于芳香族化合物
B. 尼古丁分子中的C、N原子均处于同一平面内
C. 苯并吡的分子式为C20H12
D. 苯并吡能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物水溶液,可能含有以下离子中的若干种:Na+、Ba2+、Cl﹣、CO32﹣、SO42﹣,现取200mL溶液加入BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,以下推断不正确的是
A.溶液中一定存在CO32﹣、SO42﹣、Na+B.溶液中c(Na+)≥0.6mol·L-1
C.溶液中一定没有Ba2+,可能存在Cl﹣D.溶液中n(SO42﹣)>0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制两种一定物质的量浓度的 NaOH溶液。请回答:
(1)①容量瓶上不出现的标识是___(填写字母,下同)
A.容积 B.压强 C.温度 D.密度 E.刻度线
②容量瓶所具备的功能有___。
A.可以长期贮存配制好的溶液 B.可以用来加热溶解固体溶质
C.可以用来作气体发生装置 D.配制一定体积准确浓度的标准溶液
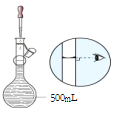
(2)用 NaOH固体配制480mL1mol·L-1NaOH溶液,用托盘天平称取___gNaOH固体。如图为配制过程的某一步操作,该操作名称是___。
(3)该同学用上述 1mol·L-1NaOH溶液配制 250mL0.1mol·L-1的 NaOH溶液。下列仪器中不必要用到的有___。
①天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管
(4)该同学在两次配制中,以下操作使所配溶液的物质的量浓度偏大的是___。
A.准取称取 NaOH固体,待溶解后立即转移到 100mL容量瓶中并定容
B.定容并摇匀,容量瓶正立后发现液面低于刻度线,继续加蒸馏水定容
C.用少量的 1mol·L-1NaOH溶液洗涤 250mL容量瓶 2~3次
D.向容量瓶中加水至超过刻度线,用胶头滴管吸出后再定容至 100mL。
(5)若向容量瓶中转移溶液时不慎有溶液溅出,处理方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将O2、CH4、Na2O2置于密闭容器中,在250℃下用电火花引发化学反应。反应停止后使容器内恢复至250℃,容器内的气压为零。由此得出的结论正确的是( )
A. 原O2、CH4、Na2O2物质的量之比为1∶2∶6,反应后容器内生成的固体是Na2CO3和NaHCO3
B. 原O2、CH4、Na2O2物质的量之比为2∶1∶4,反应后容器内生成的固体是Na2CO3和NaOH
C. 原O2、CH4、Na2O2物质的量之比为1∶2∶6,反应后容器内生成的固体是Na2CO3和NaOH
D. 原O2、CH4、Na2O2物质的量之比为2∶1∶4,反应后容器内生成的固体是NaHCO3和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2 ![]() CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
CHCl3+HCl使CCl4转化为重要的化工原料氯仿(CHCl3)。此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4 等。已知CCl4的沸点为77 ℃,CHCl3的沸点为61.2 ℃。
(1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验 序号 | 温度/℃ | 初始CCl4的浓度 (mol·L-1) | 初始H2的浓度 (mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | A |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | B |
①此反应的化学平衡常数表达式为_____________。
②实验1中,CCl4的转化率A________50%(填“大于”“小于”或“等于”)。
③实验2中,10 h后达到平衡,H2的平均反应速率为________________。
④实验3中,B的值________(填序号)。
A 等于50% B 大于50% C 小于50% D 从本题资料无法判断
(2)120 ℃时,在相同条件的密闭容器中,分别进行H2 的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。

①在图中的四条线中,表示H2的起始浓度为2 mol·L-1的实验消耗CCl4的百分率变化曲线的是________(填序号)。
②根据上图曲线,氢气的起始浓度为________ mol·L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A.检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B.检验试液中的NH4+:试液![]() 气体
气体![]() 试纸变蓝
试纸变蓝
C.检验试液中的I-:试液![]() 黄色溶液
黄色溶液![]() 深黄色溶液
深黄色溶液
D.检验试液中的Fe2+:试液![]() 无明显现象
无明显现象![]() 红色溶液
红色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Ksp[Pd(OH)2]=1.0×10-30。向物质的量浓度相同的NaOH和Na2S的混合溶液中滴加Pd(NO3)2溶液产生Pd(OH)2、PdS两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。图中的p(Pd)=-lgc(Pd2+),p(B)=-lgc(OH-)或-lgc(S2-)。下列说法错误的是( )

A. 曲线Ⅰ表示的是Pd2+与OH-浓度关系的曲线
B. 该温度下,Ksp(PdS)=1.0×10 -58
C. 升高温度时,b点可能会向c点移动
D. 该温度下,向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com