
·ÖĪö £Ø1£©Ķ¬Ņ»ÖÖŌŖĖŲ£¬“¦ÓŚ×īøß¼ŪĢ¬Ź±Ö»ÓŠŃõ»ÆŠŌ”¢“¦ÓŚ×īµĶ¼ŪĢ¬Ź±Ö»ÓŠ»¹ŌŠŌ”¢“¦ÓŚÖŠ¼ä¼ŪĢ¬Ź±¼ČÓŠŃõ»ÆŠŌÓÖÓŠ»¹ŌŠŌ£»
£Ø2£©½ŗĢå·ÖÉ¢ĻµÖŠ·ÖÉ¢ÖŹÖ±¾¶ŌŚ1-100nmÖ®¼ä£»
£Ø3£©FeCl3ČÜŅŗÓėCu·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉFe2+ŗĶCu2+£»
ÄÜŹ¹KSCNČÜŅŗ³ŹŗģÉ«µÄĪ¢Į£ŹĒFe3+£¬ČÜŅŗÖŠŗ¬ÓŠFe3+£¬ĖµĆ÷Fe3+ƻӊĶźČ«±»»¹Ō£¬Ńõ»ÆŠŌFe3+£¾Cu2+£¾Fe2+£¬ŌņČÜŅŗÖŠ»¹ŗ¬ÓŠFe2+”¢Cu2+£»
³ĮµķĪŖAgCl£¬n£ØAgCl£©=$\frac{43.05g}{143.5g/mol}$=0.3mol£¬øł¾ŻClŌ×ÓŹŲŗć¼ĘĖćc£ØCl-£©£»
£Ø4£©Fe2+ŗĶKSCNČÜŅŗ²»·“Ó¦£¬µ«Äܱ»ĖįŠŌKMnO4ČÜŅŗŃõ»Æ¶ųŹ¹KMnO4ČÜŅŗĶŹÉ«£¬Ņ²Äܱ»ĀČĘųŃõ»ÆÉś³ÉFe3+£¬ÓĆĀČĖ®ŗĶKSCNČÜŅŗ¼ģŃéŃĒFe2+Ö®Ē°±ŲŠė³żČ„Fe3+µÄøÉČÅ£»
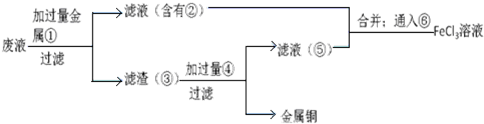
£Ø5£©·“Ó¦ŅŗÖŠŗ¬ÓŠFeCl2”¢CuCl2£¬Óɹ¤ŅÕĮ÷³ĢæÉÖŖ£¬ĀĖŌü¢ŪÖŠŗ¬ÓŠCu£¬¹ŹÓ¦ŹĒ·ĻŅŗÓė¹żĮæµÄFe·“Ó¦£¬ĀĖŅŗ¢ŚÖŠŗ¬ÓŠFeCl2£¬ĶØČėCl2æÉŅŌµĆµ½FeCl3£»ĀĖŌü¢ŪÖŠŗ¬ÓŠ½šŹōCu”¢Ī“·“Ó¦µÄFe£¬¼ÓČėŃĪĖį£¬¹żĀĖ£¬»ŲŹÕCu£¬ĀĖŅŗ¢ŻÖŠŗ¬ÓŠFeCl2£¬ÓėĀĖŅŗ¢ŚŗĻ²¢£¬ÖʱøFeCl3£®
½ā“š ½ā£ŗ£Ø1£©Ķ¬Ņ»ÖÖŌŖĖŲ£¬“¦ÓŚ×īøß¼ŪĢ¬Ź±Ö»ÓŠŃõ»ÆŠŌ”¢“¦ÓŚ×īµĶ¼ŪĢ¬Ź±Ö»ÓŠ»¹ŌŠŌ”¢“¦ÓŚÖŠ¼ä¼ŪĢ¬Ź±¼ČÓŠŃõ»ÆŠŌÓÖÓŠ»¹ŌŠŌ£¬
A£®FeÖŠFeŌŖĖŲ»ÆŗĻ¼Ū“¦ÓŚ×īµĶ¼ŪĢ¬0¼Ū£¬Ö»ÓŠ»¹ŌŠŌ£¬¹Ź“ķĪó£»
B£®ĀČ»ÆĢśŃõ»ÆŠŌ½ĻĒ棬ĒŅÖ»ÓŠŃõ»ÆŠŌ£¬¹Ź“ķĪó£»
C£®øĆĪļÖŹÖŠFeŌŖĖŲ“¦ÓŚÖŠ¼ä¼ŪĢ¬£¬¼ČÓŠŃõ»ÆŠŌÓÖÓŠ»¹ŌŠŌ£¬¹ŹÕżČ·£»
D£®øĆĪļÖŹÖŠFeŌŖĖŲ»ÆŗĻ¼ŪĪŖ+3¼Ū£¬Ö»ÓŠŃõ»ÆŠŌ£¬¹Ź“ķĪó£»
¹ŹŃ”C£»
£Ø2£©½ŗĢå·ÖÉ¢ĻµÖŠ·ÖÉ¢ÖŹÖ±¾¶ŌŚ1-100nmÖ®¼ä£¬øĆ²Ł×÷µĆµ½µÄŹĒĒāŃõ»ÆĢś½ŗĢ壬·ÖÉ¢ĻµÖŠĮ£×ÓÖ±¾¶·¶Ī§ĪŖ1-100nm£¬¹Ź“š°øĪŖ£ŗ1-100£»
£Ø3£©FeCl3ČÜŅŗÓėCu·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉFe2+ŗĶCu2+£¬Ąė×Ó·½³ĢŹ½ĪŖ2Fe3++Cu=2Fe2++Cu2+£¬
ÄÜŹ¹KSCNČÜŅŗ³ŹŗģÉ«µÄĪ¢Į£ŹĒFe3+£¬ČÜŅŗÖŠŗ¬ÓŠFe3+£¬ĖµĆ÷Fe3+ƻӊĶźČ«±»»¹Ō£¬Ńõ»ÆŠŌFe3+£¾Cu2+£¾Fe2+£¬ŌņČÜŅŗÖŠ»¹ŗ¬ÓŠFe2+”¢Cu2+£»
³ĮµķĪŖAgCl£¬n£ØAgCl£©=$\frac{43.05g}{143.5g/mol}$=0.3mol£¬øł¾ŻClŌ×ÓŹŲŗć¼ĘĖćc£ØCl-£©=$\frac{n£ØC{l}^{-}£©}{V}$=$\frac{n£ØAgCl£©}{V}$=$\frac{0.3mol}{0.05L}$=6.0mol/L£¬
¹Ź“š°øĪŖ£ŗ2Fe3++Cu=2Fe2++Cu2+£» Fe3+”¢Fe2+”¢Cu2+£»6.0£»
£Ø4£©A£®ĻņŹŌ¹ÜÖŠ¼ÓČėŹŌŅŗ£¬µĪČėKSCNČÜŅŗ£¬ČōĻŌŃŖŗģÉ«£¬Ö¤Ć÷ŗ¬ÓŠFe3+£¬ŃĒĢśĄė×ÓŗĶKSCNČÜŅŗ²»·“Ó¦£¬ĖłŅŌÓĆKSCNČÜŅŗĪŽ·Ø¼ų¶ØŹĒ·ńŗ¬ÓŠŃĒĢśĄė×Ó£¬¹Ź“ķĪó£»
B£®ŃĒĢśĄė×Ó¾ßÓŠ»¹ŌŠŌ£¬Äܱ»ĖįŠŌøßĆĢĖį¼ŲČÜŅŗŃõ»Æ¶ųŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬ĖłŅŌĻņŹŌ¹ÜÖŠ¼ÓČėŹŌŅŗ£¬µĪČėĖįŠŌøßĆĢĖį¼ŲČÜŅŗ£¬ČōĶŹÉ«£¬Ö¤Ć÷ŗ¬ÓŠFe2+£¬¹ŹÕżČ·£»
C£®ĻņŹŌ¹ÜÖŠ¼ÓČėŹŌŅŗ£¬µĪČėĀČĖ®£¬ŌŁµĪČėKSCNČÜŅŗ£¬ČōĻŌŃŖŗģÉ«£¬Ö¤Ć÷ŌČÜŅŗÖŠŗ¬ÓŠFeŌŖĖŲ£¬²»ÄÜĖµĆ÷ŹĒ·ńŗ¬ÓŠŃĒĢśĄė×Ó”¢ĢśĄė×Ó»¹ŹĒ¶žÕ߶¼ÓŠ£¬¹Ź“ķĪó£»
¹ŹŃ”B£»
£Ø5£©·“Ó¦ŅŗÖŠŗ¬ÓŠFeCl2”¢CuCl2£¬Óɹ¤ŅÕĮ÷³ĢæÉÖŖ£¬ĀĖŌü¢ŪÖŠŗ¬ÓŠCu£¬¹ŹÓ¦ŹĒ·ĻŅŗÓė¹żĮæµÄFe·“Ó¦£¬ĀĖŅŗ¢ŚÖŠŗ¬ÓŠFeCl2£¬ĶØČėCl2æÉŅŌµĆµ½FeCl3£»ĀĖŌü¢ŪÖŠŗ¬ÓŠ½šŹōCu”¢Ī“·“Ó¦µÄFe£¬¼ÓČėŃĪĖį£¬¢ÜĪŖHCl£¬¹żĀĖ£¬»ŲŹÕCu£¬ĀĖŅŗ¢ŻÖŠŗ¬ÓŠFeCl2£¬ÓėĀĖŅŗ¢ŚŗĻ²¢£¬ÖʱøFeCl3£¬
ĶعżŅŌÉĻ·ÖĪöÖŖ£¬¢Ł¢Ś¢Ū¢Ü·Ö±šŹĒFe”¢FeŗĶCu”¢HCl£¬
¹Ź“š°øĪŖ£ŗ¢ŁFe£»¢ŚFeCl2£»¢ŪFe Cu£»¢ÜHCl£®
µćĘĄ ±¾ĢāŅŌFe¼°Ęä»ÆŗĻĪļĪŖŌŲĢåæ¼²éĪļÖŹ·ÖĄėŗĶĢį“攢Ńõ»Æ»¹Ō·“Ó¦”¢Ąė×Ó¼ģŃ锢½ŗĢåµČÖŖŹ¶µć£¬Ć÷Č·ĪļÖŹŠŌÖŹ²īŅģŠŌ”¢Ńõ»Æ»¹Ō·“Ó¦ŌĄķ”¢Ąė×Ó¼ģŃé·½·Ø¼°ĻÖĻóŹĒ½ā±¾Ģā¹Ų¼ü£¬×¢Ņā£ŗ¼ģŃéĄė×ÓŹ±ŅŖÅųżĘäĖüŅņĖŲµÄøÉČÅ£¬Čē£Ø4£©CŃ”Ļī£¬ĢāÄæÄŃ¶Č²»“ó£®


 µ¼Ń§½Ģ³ĢøßÖŠŠĀæĪ±źĻµĮŠ“š°ø
µ¼Ń§½Ģ³ĢøßÖŠŠĀæĪ±źĻµĮŠ“š°ø Š”ѧæĪŹ±ĢŲѵĻµĮŠ“š°ø
Š”ѧæĪŹ±ĢŲѵĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
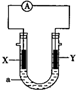
| A£® | XĪŖøŗ¼«£¬µē¼«·“Ó¦ĪŖ£ŗAl-3e-ØTAl3+ | |
| B£® | XĪŖÕż¼«£¬µē¼«·“Ó¦ĪŖ£ŗ2H2O+O2+4e-ØT4OH- | |
| C£® | YĪŖøŗ¼«£¬µē¼«·“Ó¦ĪŖ£ŗMg-2e-ØTMg2+ | |
| D£® | YĪŖÕż¼«£¬µē¼«·“Ó¦ĪŖ£ŗ2H2O+2e-ØT2OH-+H2”ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
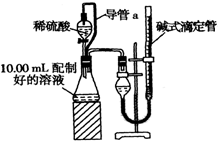 ŹµŃéŹŅ²ā¶ØĢ¼ĖįÄĘŗĶĢ¼ĖįĒāÄĘ»ģŗĻĪļÖŠĢ¼ĖįÄʵÄÖŹĮæ·ÖŹżW£ØNa2CO3£©£¬³ĘČ”“Ė»ģŗĻĪļ5.0g£¬ČÜÓŚĖ®ÖŠ£¬Åä³É250mLČÜŅŗ£®
ŹµŃéŹŅ²ā¶ØĢ¼ĖįÄĘŗĶĢ¼ĖįĒāÄĘ»ģŗĻĪļÖŠĢ¼ĖįÄʵÄÖŹĮæ·ÖŹżW£ØNa2CO3£©£¬³ĘČ”“Ė»ģŗĻĪļ5.0g£¬ČÜÓŚĖ®ÖŠ£¬Åä³É250mLČÜŅŗ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ģ¼ĖįøĘÓėŃĪĖį·“Ó¦£ŗCO32-+2H+ØTCO2”ü+H2O | |
| B£® | ĮņĖįĶČÜŅŗÖŠµĪ¼ÓĒāŃõ»Æ±µČÜŅŗ£ŗBa2++2OH-+Cu2++SO42-ØTBaSO4”ż+Cu£ØOH£©2”ż | |
| C£® | ĻõĖįŅųČÜŅŗÖŠ¼ÓČėĶ·Ū£ŗAg++CuØTCu2++Ag”ż | |
| D£® | ĢśÓėĻ”ŃĪĖį·“Ó¦£ŗ2Fe+6H+ØT2Fe3++3H2”ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻņCaCl2ČÜŅŗÖŠĶØČė¹żĮæSO2 | |
| B£® | ĻņNa2SiO3ČÜŅŗÖŠµĪČė¹żĮæµÄŃĪĖį | |
| C£® | Ļņ±„ŗĶµÄNa2CO3ČÜŅŗÖŠĶØČė¹żĮæCO2 | |
| D£® | ĻņAl2£ØSO4£©3ČÜŅŗÖŠµĪČė¹żĮæµÄNaOHČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚ±ź×¼×“æöĻĀ£¬·Ö×Ó×ÜŹżĪŖNAµÄH2ŗĶO2»ģŗĻĘųĢ壬ĘäĢå»żŌ¼ĪŖ22.4L | |
| B£® | 5.6gĢśÓė×ćĮæµÄĀČĘų·“Ó¦£¬×ŖŅʵē×ÓŹżĪŖ0.2NA | |
| C£® | 11.2LH2OĖłŗ¬ÓŠµÄŌ×ÓŹżĪŖ1.5NA | |
| D£® | 0.2mol/LµÄNa2CO3ČÜŅŗÖŠŗ¬ÓŠµÄNa+ŹżĪŖ0.4NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
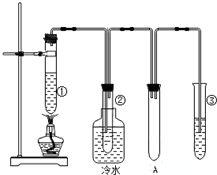 ŹÆĄÆÓĶ£Ø17øöĢ¼Ō×ÓŅŌÉĻµÄŅŗĢ¬ĶéĢž»ģŗĻĪļ£©µÄ·Ö½āŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£Ø²æ·ÖŅĒĘ÷ŅŃŗöĀŌ£©£®ŌŚŹŌ¹Ü¢ŁÖŠ¼ÓČėŹÆĄÆÓĶŗĶŃõ»ÆĀĮ£Ø“ß»ÆŹÆĄÆ·Ö½ā£©£»ŹŌ¹Ü¢Ś·ÅŌŚĄäĖ®ÖŠ£¬ŹŌ¹Ü¢ŪÖŠ¼ÓČėäåĖ®£®
ŹÆĄÆÓĶ£Ø17øöĢ¼Ō×ÓŅŌÉĻµÄŅŗĢ¬ĶéĢž»ģŗĻĪļ£©µÄ·Ö½āŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£Ø²æ·ÖŅĒĘ÷ŅŃŗöĀŌ£©£®ŌŚŹŌ¹Ü¢ŁÖŠ¼ÓČėŹÆĄÆÓĶŗĶŃõ»ÆĀĮ£Ø“ß»ÆŹÆĄÆ·Ö½ā£©£»ŹŌ¹Ü¢Ś·ÅŌŚĄäĖ®ÖŠ£¬ŹŌ¹Ü¢ŪÖŠ¼ÓČėäåĖ®£®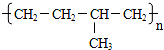 B£®
B£®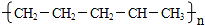
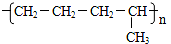 D£®
D£®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com