
| A. | 苛性钠Na2CO3 | B. | 胆矾CuSO4 | C. | 苏打NaHCO3 | D. | 火碱NaOH |
科目:高中化学 来源: 题型:选择题
| A. | 将少量Na2O2粉末加入到H218O水中:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| B. | 向AlC13溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 氯化亚铁溶液中通入足量C12:Fe2++C12═Fe3++2C1- | |
| D. | 往NH4HSO4溶液中加入足量NaOH溶液:NH4++H++2OH-═NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
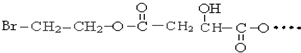
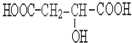 请回答:
请回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
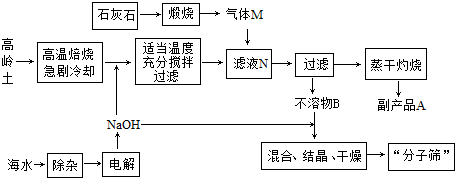
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.| 引起误差的一些错误操作 | 对CB的影响 |
| 定容时,俯视刻度线 | 偏大 |
| 转移溶液时,玻璃棒下端靠在容量瓶刻度线以上 | 偏小 |
| 洗涤量取浓溶液的量筒并将洗涤液转移到容量瓶 | 偏大 |
| 定容后,经振荡、摇匀、静置、液面低于刻度线再加水 | 偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
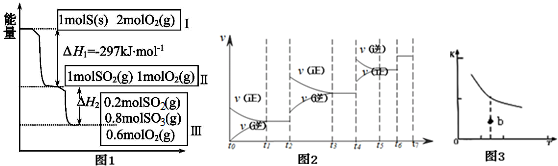
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| B. | 向50mL 18mol/L 硫酸中加入足量铜片并加热,被还原硫酸的物质的量是0.45mol | |
| C. | 浓硫酸溅到皮肤上,立即用碳酸钠稀溶液冲洗 | |
| D. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水色后加热也能恢复原色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com