
【题目】下列过程吸收热量的是
A. 液氨气化 B. 生石灰加入水中
C. 天然气燃烧 D. 盐酸与氢氧化钾溶液反应
科目:高中化学 来源: 题型:
【题目】化学反应速率受外界条件如反应温度、反应物浓度、压强、催化剂等的影响.烧烤时,用扇子向红热的木炭扇风,火会更旺,其原因是( )
A.压强降低,反应减慢
B.温度降低,反应加快
C.使CO2浓度增加,反应加快
D.使O2浓度增加,反应加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.pH=2的酸溶液1mL,加水稀释至100mL后,溶液pH=4
C.过量SO2通入Ba(NO3)2溶液中,正确的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4![]() +2NO
+2NO![]() +4H+
+4H+
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液,所消耗的醋酸溶液的体积分别为![]() 和
和![]() ,则
,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中各粒子的物质的量浓度关系正确的是
A.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
B.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③
C.0.2 mol/L的NaHCO3溶液与0.3 mol/L的Ba(OH)2溶液等体积混合,所得溶液中:c(OH-)>c(Ba2+)>c(Na+)>c(H+)
D.等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO![]() )+c(H2CO3)+c(CO
)+c(H2CO3)+c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向。如果电动汽车上使用新型钒电池,一次性充电3—5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的1/25和1/10。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:
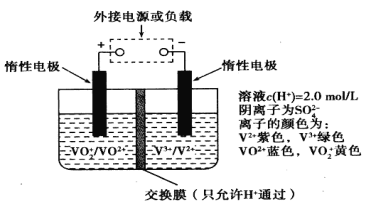
下列有关该钒电池的说法不正确的是( )
A.该电池为可逆电池, 当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液PH值升高
B.放电过程中,右槽溶液中溶液颜色由紫色变为绿色
C.充电过程中, H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应
D.充电时若转移的电子数为3.01![]() 1023个,左槽溶液中n(H+)增加了0.5mol
1023个,左槽溶液中n(H+)增加了0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
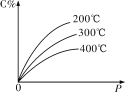
A.达到平衡后,若升高温度,平衡右移
B.达到平衡后,加入催化剂C%增大
C.化学方程式中“n>e+f”
D.达到平衡后,增加A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A、B、C、D四种分离物质的方法,从其分离的原理来看,有一种与其他三种不同。这种方法是
A.用蒸发水分的方法使海水中的盐析出
B.用加热蒸馏的方法,从工业酒精中获得95.6%的乙醇
C.用加热升华的方法把单质碘从它和碘化钾固体形成的混合物中分离出来
D.用加热的方法,把掺杂在NaCl固体中的少量NH4HCO3固体除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】矿盐(主要成分是NaCl,还含有SO![]() 等其他可溶性杂质的离子),下列有关说法正确的是
等其他可溶性杂质的离子),下列有关说法正确的是
A.由矿盐生产食盐,除去SO![]() 最合适的试剂是Ba(NO3)2
最合适的试剂是Ba(NO3)2
B.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
C.侯氏制碱法中,向饱和在食盐水中先通入二氧化碳,然后再通入氨气
D.工业上通过电解氯化钠溶液制备金属钠和氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com