
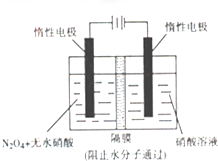
| 1 |
| 2 |
| ||
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水和冰的混合物,澄清石灰水 |
| B、净化后的空气,氧化镁 |
| C、生锈的铁钉,高锰酸钾充分加热后的剩余固体 |
| D、氯化钾,液氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分馏、干馏、裂化都是化学变化 |
| B、聚乙烯、聚氯乙烯、纤维素都是合成高分子 |
| C、硫酸铜、醋酸、铁都是电解质 |
| D、盐酸、漂白粉、铝热剂都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
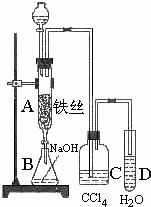 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目:高中化学 来源: 题型:
 数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 紫外线 |
| A、单位时间内生成2 mol O3,同时消耗3 mol O2 |
| B、O2的消耗速率0.3 mol?L-1?s-1,O3的消耗速率0.2 mol?L-1?s-1 |
| C、容器内,2种气体O3、O2浓度相等 |
| D、气体的密度不在改变. |
查看答案和解析>>
科目:高中化学 来源: 题型:
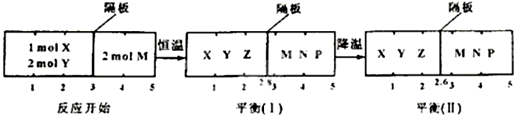
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com