一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol∕L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol.
(1)写出氢气在氯气中燃烧反应的化学方程式和现象:______ 2HCl
【答案】
分析:氢气在氯气中燃烧生成HCl,反应的方程式为H
2+Cl
2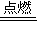
2HCl,氯气过量,混合气体与NaOH溶液反应:
2NaOH+Cl
2=NaCl+NaClO+H
2O,NaOH+HCl=NaCl+H
2O,根据反应的方程式计算.
解答:解:(1)氢气在氯气中安静地燃烧,发出苍白色火焰,生成HCl,反应的方程式为H
2+Cl
2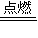
2HCl,故答案为:H
2+Cl
2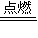
2HCl、安静燃烧,发出苍白色火焰;
(2)根据溶液电中性原则可知:n(Na
+)=n(Cl
-)+n(ClO
-),
n(Cl
-)=n(Na
+)-n(ClO
-)=0.1L×3.00mol/L-0.0500mol=0.25mol,故答案为:0.25;
(3)根据Cl原子守恒可知,n(Cl
2)=

×n(NaOH)=0.15mol,
设与NaOH反应的Cl
2物质的量为x,
2NaOH+Cl
2=NaCl+NaClO+H
2O
1mol 1mol
x 0.05mol
x=0.05mol,
设参加反应的氢气的物质的量为y,
H
2+Cl
2
2HCl
1mol 1mol
y 0.15mol-0.05mol
y=0.1mol,
所用氯气和参加反应的氢气的物质的量之比n(Cl
2):n(H
2)=0.15mol:0.1mol=3:2,
故答案为:3:2.
点评:本题考查物质的量应用于化学方程式的计算,题目难度不大,注意从守恒的角度解答.

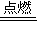 2HCl,氯气过量,混合气体与NaOH溶液反应:
2HCl,氯气过量,混合气体与NaOH溶液反应: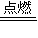 2HCl,故答案为:H2+Cl2
2HCl,故答案为:H2+Cl2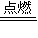 2HCl、安静燃烧,发出苍白色火焰;
2HCl、安静燃烧,发出苍白色火焰; ×n(NaOH)=0.15mol,
×n(NaOH)=0.15mol, 2HCl
2HCl

 名校课堂系列答案
名校课堂系列答案