
| A. | 钠在实验室通常保存在煤油中,可推知锂也可保存在煤油中 | |
| B. | FeCl2与Cl2反应生成FeCl3,可推知FeBr2也可与Br2反应生成FeBr3 | |
| C. | 工业制Mg采用电解MgCl2的方法,可推知工业制Al也采用电解AlCl3的方法 | |
| D. | CO2通入Ba(NO3)2溶液中无明显现象,可推知SO2通入Ba(NO3)2溶液中也无明显现象 |
分析 A.依据煤油的密度小于钠,大于锂解答;
B.氯气、溴氧化性强于三价铁离子;
C.氯化镁为离子化合物,氯化铝共价化合物;
D.二氧化硫能够被硝酸根离子氧化生成硫酸根离子.
解答 解:A.煤油的密度小于钠,大于锂,钠放在煤油中能够沉在底部,起到隔绝空气作用,而锂密度小于煤油,浮在煤油上,不能隔绝空气,故A错误;
B.氯气、溴氧化性强于三价铁离子,氯气、溴都能够氧化二价铁离子生成三价铁离子,故B正确;
C.氯化铝是共价化合物,熔融状态下不导电,所以不能用电解质熔融氯化铝方法制取铝,故C错误;
D.二氧化硫能够被硝酸根离子氧化生成硫酸根离子,所以二氧化硫通入Ba(NO3)2溶液中,生成白色的硫酸钡沉淀,故D错误;
故选:B.
点评 本题考查了元素化合物知识,明确相关物质的性质及电解池工作原理是解题关键,题目难度不大.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 4种 | C. | 5种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
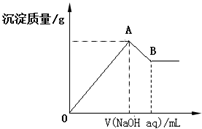
| A. | x=$\frac{3a}{5-a}$ | |
| B. | x的取值范围是0<x<$\frac{11}{32}$ | |
| C. | A点横坐标的值不随x发生变化 | |
| D. | 若B点横坐标为200mL时,c(NaOH)=7.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该混合粉末从组成看,其成分皆是碱性氧化物 | |
| B. | 溶液Y 中2n(Mg2+)<n(Cl-)<3n(Fe3+) | |
| C. | 沉淀X的成分为二氧化硅 | |
| D. | 在溶液Y 中加入过量的氨水,过滤得到的沉淀的成分是氢氧化铁和氢氧化镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2、FeCl3 | B. | NaHCO3、Na2CO3 | C. | NaAlO2、AlCl3 | D. | Mg(HCO3)2、MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
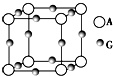 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中金属共失去电子0.1 mol | |
| B. | 合金中,铜的质量为2.8 g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5 mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5 mol•L-1的NaOH溶液60 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com