
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、Cl-
D.pH=12的溶液:K+、Na+、CH3COO-、Br-
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源:2014-2015学年吉林省长春市高三质量监测三理综化学试卷(解析版) 题型:选择题
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.元素Z可与元素X形成共价化合物XZ2
B.元素X与氢形成的原子比为1∶1的化合物有很多种
C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素W、X的氯化物中,各原子均满足8电子的稳定结构
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:选择题
电渗析法是一种利用离子交换膜进行海水淡化的方法,工作原理如图所示。下列有关说法错误的是
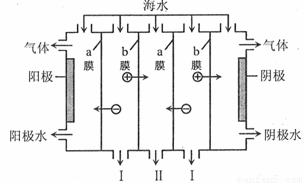
A.阳极可发生电极反应: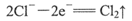
B.阴极附近溶液的pH减小
C.a膜为阴离子交换膜, b膜为阳离子交换膜
D.I、II分别是淡水、浓海水出口
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河西区高三下学期总复习质量调查(二)化学试卷(解析版) 题型:选择题
臭氧在烟气脱硝中的反应为2NO2(g) + O3(g) N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图象如下列选项,其中对应分析结论正确的是
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图象如下列选项,其中对应分析结论正确的是
A | B | C | D |
|
|
|
|
平衡后升温, NO2含量降低 | 0~2 S内, v(O3)=0.2 mol·L-1·s-1 | v正 :b点> a点 b点:v逆 > v正 | 恒温, t1时再充入O3 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
(18分)正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
(CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
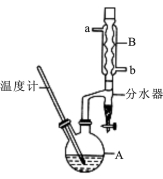
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70 mL水的温度分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加 。
(2)加热A前,需先从 (填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去 ,振摇后静置,粗产物应 (填“上”或“下”)口倒出。
(4)步骤③中最后一次水洗的目的为 。
(5)步骤⑤中,加热蒸馏时应收集 (填选项字母)左右的馏分。
A.100℃ B.117℃ C.135℃ D.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为 ,下层液体的主要成分为 。
(7)本实验中,正丁醚的产率为 (精确到1%)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期第二次月考化学试卷(解析版) 题型:简答题
液晶高分子材料应用广泛。新型液晶基元——化合物Ⅳ的合成线路如下:
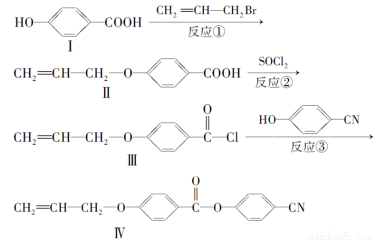
(1)化合物Ⅰ的分子式为________,1 mol化合物Ⅰ最多可与________mol NaOH反应。
(2)CH2=CH—CH2Br与NaOH水溶液反应的化学方程式为(注明条件)______________。
(3)化合物Ⅰ的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中一种同分异体的结构简式____________________。
(4)下列关于化合物Ⅱ的说法正确的是_______(填字母)。
A.属于烯烃 B.能与FeCl3溶液反应显紫色
C.一定条件下能发生加聚反应 D.能使溴的四氯化碳溶液褪色
(5)反应③的反应类型是________。在一定条件下,化合物 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期第二次月考化学试卷(解析版) 题型:选择题
下列反应的离子方程式表示不正确的是
A.漂白粉溶液在空气中长时间放置:ClO-+CO2+H2O = HClO+HCO
B.FeBr2溶液中通入少量Cl2:2Fe2++Cl2 =2Fe3++2Cl-
C.AgNO3溶液中加入过量稀氨水:Ag++2NH3·H2O = [Ag(NH3)2]++2H2O
D.SO2使氯水褪色:SO2+Cl2+2H2O =SO42-+2Cl-+4H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市第二次诊断性测试化学试卷(解析版) 题型:简答题
(14分)已知ABCDEF六种元素的原子序数依次增加,ABCD位于前三周期A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子总数是未成对电子总数的3倍ABD三种元素组成的一种化合物M可用于配制化妆品,是皂化反应的产物之一;AB两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂E有“生物金属”之称,E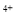 离子和氩原子的核外电子排布相同,元素F的三价阳离子3d轨道处于半充满状态请回答下列问题(答题时,ABCDEF用所对应的元素符号表示)
离子和氩原子的核外电子排布相同,元素F的三价阳离子3d轨道处于半充满状态请回答下列问题(答题时,ABCDEF用所对应的元素符号表示)
(1)E的基态原子的外围电子排布式为
(2)上述非金属元素中电离能最大的元素是
(3)下列叙述正确的是 (填字母)
a.M与水分子间能形成氢键,N是非极性分子
b.M和BD2分子中的中心原子均采用sp2杂化
c.N分子中含有6个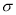 键和1个
键和1个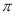 键
键
d.BD2晶体的熔点沸点都比二氧化硅晶体的低
(4)与BCD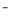 互为等电子体的微粒的化学式为 (任写一种)
互为等电子体的微粒的化学式为 (任写一种)
(5)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6组成为ECl3·6H20的绿色晶体,该晶体属于配合物,有两种配体,其物质的量之比为1:5,则该配离子的化学式为
(6)电镀厂排放的废水中常含有剧毒的BC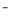 离子,可在催化剂的催化下,先用NaClO将BC
离子,可在催化剂的催化下,先用NaClO将BC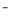 氧化成BCD
氧化成BCD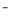 ,再在酸性条件下BCD
,再在酸性条件下BCD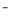 继续被NaClO氧化成C2和BD2则后一步反应的离子方程式是
继续被NaClO氧化成C2和BD2则后一步反应的离子方程式是
(7)F的低价硫酸盐的溶液在空气中易变质,检验其在空气中是否已完全变质的实验操作是 (要求写出操作现象结论)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(13分)元素A、B、C、D、E、F原子序数依次增大,且都为短周期元素。A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族;E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6。
(1)由A、C、F三种元素按原子个数比1∶1∶1组成的化合物的电子为 ,
该化合物与BA3反应生成B的单质,写出该反应的化学反应方程式 。
(2)将化合物EC2通入只含有 n mol 化合物D2E的溶液中,充分反应后,溶液出现浑浊,则该化合物D2E的溶液最多能吸收化合物EC2的物质的量为 (不考虑水中溶解的化合物EC2)
(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的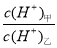 = ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
= ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(4)电解由A与F形成化合物的溶液时,若阴、阳极都用石墨作电极,则阴极发生 反应(填“氧化”、“还原”),阳极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com