
在500mL AgNO3溶液中插入惰性电极进行电解,当阴极质量增加54mg时,溶液的pH变化如何?设电解前AgNO3溶液pH=6(电解过程中溶液体积变化忽略不计)。
科目:高中化学 来源: 题型:038
在500mL AgNO3溶液中插入情性电极进行电解,当阴极质量增加54mg时,溶液的pH变化如何?设电解前AgNO3溶液pH=6(电解过程中溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市天津一中高一上学期期末考试化学试卷(带解析) 题型:计算题
在500mL 0.1 mol·L-1的FeCl2溶液中通入一定量Cl2,待反应结束后,将溶液稀释到1 L,再取出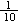 稀溶液加入足量的AgNO3溶液,得到2.009g沉淀。
稀溶液加入足量的AgNO3溶液,得到2.009g沉淀。
(1)原溶液中被氧化的Fe2+的物质的量为__________mol。
(2)若将剩余的Fe2+全部氧化,还需加入0.5 mol·L-1的稀硝酸_________ mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com