
【题目】不能正确表示下列变化的离子方程式是
A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+
C.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O=2
+CO2+H2O=2![]() +CO32—
+CO32—
D.醋酸钠水解:CH3COO+H2O![]() CH3COOH+OH
CH3COOH+OH
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
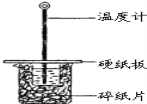
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;
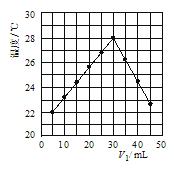
(4)若将V1mL1.0molL-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
a.CH3CH3 b.CH3CHCl2 c.CH3CH2OH d.CH3CH2Br
(4)已知 2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
![]()
反应②的化学方程式为_________。 工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为_____________,反应类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中不存在电子转移的是( )
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
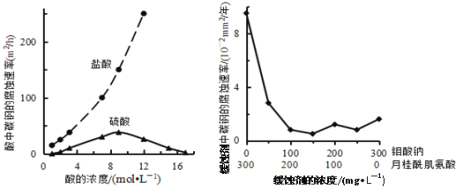
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下pH=2的H3PO4溶液,下列说法正确的是( )
A.c(H3PO4)=![]() mol/L
mol/L
B.c(H+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() )+c(OH-)
)+c(OH-)
C.加水稀释使电离度增大,溶液pH减小
D.加入NaH2PO4固体,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,在一定的条件下,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2B.若甲为Fe,则丁可能是氯气
C.若甲为Fe,则丁可能是硝酸D.若甲为NaOH 溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排措施是我国“十一五”期间提出的政策措施。
(1)煤的燃烧,会产生大量有害气体。将煤转化为水煤气,可有效降低排放。
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式___________。
(2)汽车尾气的排放是大气污染物的重要来源,其中含有NO气体。根据资料显示用活性炭还原法可以处理氮氧化物,某硏究小组向固定容积的密闭容器中加入一定量的活性炭和NO发生反应C(s)+2NO(g)![]() CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
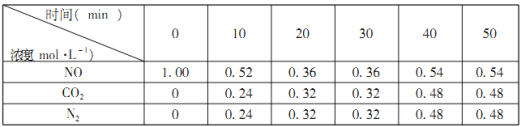
①0到10min内,NO的平均反应速率v(NO)=___________mol·L-1·min-1。
②下列数据不再变化可表示该反应达到平衡的是___________。
a.容器内压强 b.混合气体的平均摩尔质量 c.混合气体的密度
③若容器改为可变容积容器,达平衡后,再充入少量NO气体,再次达到平衡时N2的浓度 ____________(填“增大”,“减小”,或“不变”)
(3)在某温度T时能同时发生反应:
2N2O5(g)![]() 2N2O4(g)+O2(g) K1
2N2O4(g)+O2(g) K1
N2O4(g)![]() 2NO2(g) K2
2NO2(g) K2
若向一体积固定为2L的密闭容器内加入N2O5 2mol,一段时间后,容器内的反应达到平衡,此时n(NO2)=0.4mol,已知K2=0.1,请计算出K1=___________。
(4)在一定温度下,有a、硫酸氢钠b、硫酸c、醋酸三种溶液,若三者c(H+)相同时,物质的量浓度由大到小的顺序是_____,当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯二氧化硅可用下列流程制得。下列说法不正确的是( )
![]()
A.X可用作木材防火剂
B.步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3↓+Na2SO4
C.步骤Ⅱ中的稀硫酸可用CO2来代替
D.步骤Ⅲ若在实验室完成,一般在蒸发皿中进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com