
【题目】某烃分子中有40个电子,它燃烧时生成等体积的CO2和H2O(g),该有机物的分子式为 ( )
A.C4H8
B.C4H10
C.C5H10
D.C5H12
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:

(1)非金属性最强的是___(填元素名称),化学性质最不活泼的是____(填元素符号)。
(2)元素①-⑩中半径最大的元素是____(填元素符号)
(3)②、③、⑨的最高价含氧酸的酸性由强到弱的顺序是________。(填化学式)
(4)表中能形成两性氢氧化物的元素是______(填元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中含镁元素的反应物作还原剂的是( )
A.MgCO3=MgO+CO2↑
B.Mg(OH)2+2H+=Mg2++2H2O
C.Mg+2HCl=MgCl2+H2↑
D.Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工作流程如下:
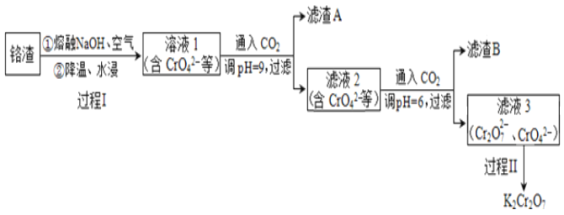
(1)铝热法冶炼金属铬,是利用了金属铝的______(填“氧化性”或“还原性”)。
(2)溶液1中的主要的阴离子有CrO42-、_____(填离子符号)。
(3)过程I,在Cr2O3参与的反应中,若生成0.4 molCrO42-,消耗氧化剂的物质的量是_______。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是_______。
②滤渣B受热分解所得物质可以循环利用,B是________(填化学式)。
③已知:2CrO42-+2H+![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04 mol/L,则CrO42-的浓度是_____mol/L。
(5)过程II的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7。
不同温度下化合物的溶解度(g/100gH2O)
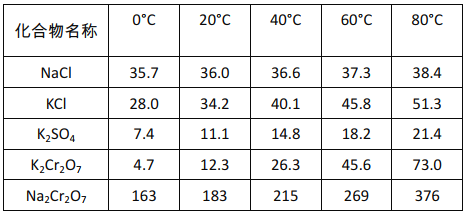
结合表中数据分析,过程II得到K2Cr2O7粗品的操作是:______,过滤得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据元素周期表和元素周期律得出的推断中正确的是( )
A. ![]() 与
与![]() 得电子能力相同
得电子能力相同
B. 由于HCl水溶液的酸性强于H2S水溶液的酸性,因此氯的非金属性强于硫
C. Cl-、S2-、Ca2+、K+半径逐渐减小
D. 金属元素原子最外层电子数越少,该金属失电子能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2 L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
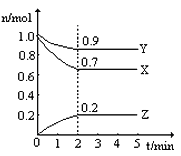
(1)该反应第_______分钟到达平衡状态 。
(2)该反应的化学方程式为____________ 。
(3)2 min时,Y的浓度为___________。
(4)反应开始至2 min,气体X的平均反应速率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如下表,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
A | ||
E |
(1)C在元素周期表中的位置为_______,其简单离子的结构示意图为____。
(2)AE2的化学式为_______。
(3)C、E、F的单质沸点最低的是__________(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___________________(填离子符号)。
(5)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,应用广泛。采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如图15所示。请回答下列问题:
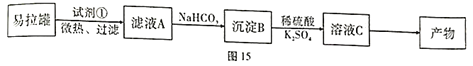
(1)请写出Al3+的结构示意图:______________________。
(2)试剂①最好选用___________(填序号)。写出A溶解的化学方程式:_________________________。
A.HCl溶液 B.H2SO4溶液 C.NaOH溶液 D.氨水
(3)写出滤液A到沉淀B的离子方程式:______________________;室温下,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13,H2CO3的Ka1=1×10-7,Ka2=4×10-11,计算滤液A到沉淀B的平衡常数 K=___________。
AlO2-+H++H2O K=2.0×10-13,H2CO3的Ka1=1×10-7,Ka2=4×10-11,计算滤液A到沉淀B的平衡常数 K=___________。
(4)写出由溶液C得到产物的操作:__________________________________。
(5)常温下,pH值相等的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com