
【题目】下列说法正确的是(设阿伏加德罗常数的数值为NA)( )
A. 在标准状况下,22.4L水所含分子数目为NA
B. 1mol·L-1K2SO4溶液所含K+数目为2NA
C. 1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA
D. O2的摩尔体积约为22.4 L·mol-1
科目:高中化学 来源: 题型:
【题目】关于X、Y、Z三种元素,有以下五点信息
① X、Y、Z的单质在常温下均为气体;
② X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
③ XZ极易溶于水,在水溶液中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红;
④ 每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
⑤ Z单质溶于X2Y中,所得溶液具有漂白性。
(1)试写出Z的元素符号______;化合物XZ的电子式:_______,X2Y的结构式_________。
(2)用电子式表示XZ的形成过程_________________________________________________。
(3)写出信息⑤中的化学方程式__________________________________________________。
(4)X2、Y2和KOH溶液一起可以构成新型燃料电池,写出该电池的总反应方程式:
_______________________
已知拆开1mol X—X键、1mol Z—Z键、1mol X—Z键分别需要吸收的能量为436kJ、243kJ、432kJ,计算反应X2(g)+Z2(g)=2XZ(g)的ΔH=________kJ/mol .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有3个H—H键断裂;
②一个N≡N键断裂的同时,有2个N—H键断裂;
③N2、H2、NH3浓度比为1:3:2
④保持其它条件不变时,体系压强不再改变;
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体的密度保持不变;
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.②⑤⑥ B.①④⑤ C.④⑤⑦ D.③⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列有关说法正确的是( )
A.该合成中所有的电能和热能全部转化为化学能
B.该合成氨过程不属于氮的固定
C.空气、水、太阳能均为可再生资源
D.断裂N2中的N≡N键会释放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去NaCl中含有的Ca2+、Mg2+、SO42-、CO3-等离子,通常采用以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④HCl。加入试剂合理的操作顺序是( )
A.①②③④ B.③①②④ C.④②①③ D.③②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为常见气体制各、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
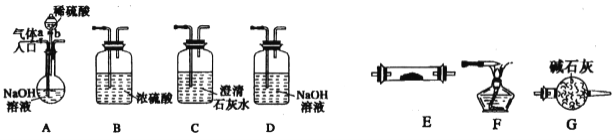
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为A→____→____→E→____→____(填代号)。能验证CO氧化产物的现象是_______________。
(2)若气俸入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网(做催化剂),按A→G→E→D装置顺序制取干燥的氨气并验证氨的某些性质。
①写出装置A中能产生氨气的两个原因:__________;___________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有__________性。E中发生反应的化学方程式: __________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石英、焦炭为原料的部分化工流程如图所示。

回答下列问题:
(1)反应I在工业上的作用是生产粗硅,为鉴定产品R中是否含有微量的铁单质,取少量R,用稀盐酸溶解,取上层清液后需再加入的试剂是______(填字母)。
a.碘水 b.氯水 c.KSCN溶液 d.NaCl溶液
(2)反应Ⅱ要在干燥环境下迸行,其原因是______;经冷凝得到的SiHCl3(沸点为33.0℃)中含有少量SiCl4沸点为57.6℃)和HC1(沸点为- 84.7℃),则提纯SiHCl3的方法为______________。
(3)将水蒸气通过灼热的煤粉可产生水煤气,其主要成分是CO、H2。工业上将水煤气液化后制得的CH3OH中含有的化学键类型为________(填“离子键”或“共价键”);流程图中的反应Ⅲ为氧化还原反应,其化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体 ⑦恒容通入COCl2气体,能提高COCl2转化率的是( )
A.①④⑥⑦ B.①④⑥ C.①②④⑦ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是
A. 将海水蒸馏可以得到淡水
B. 萃取实验中需要分液操作
C. 可以用过滤的方法分离NaCl溶液和植物油
D. 除去硝酸钾固体中的少量氯化钠可以将混合物制成热饱和溶液,冷却结晶,过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com