
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol•L-1 HCN溶液与b mol•L-1 NaOH溶液等体积混合后,若所得溶液中c(Na+)>c(CN-),则a可能大于b | |
| C. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度均先增大后减小 | |
| D. | NaHCO3溶液中,一定存在c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
分析 A、弱酸的电离平衡常数越大,酸性越强,反之酸性越弱,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大;
B、如c(Na+)>c(CN-),根据溶液电中性可知c(H+)<c(OH-),溶液呈碱性;
C、冰醋酸属于弱电解质,加水促进电离;
D、根据溶液的物料守恒判断.
解答 解:A、根据电离平衡常数可知酸性强弱顺序为:CH3COOH>HCN>HCO3-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A错误;
B、如c(Na+)>c(CN-),根据溶液电中性可知c(H+)<c(OH-),溶液呈碱性,少量的HCN与NaC混合溶液显碱性,HCN的物质的量可能大于NaOH,即a可能大于b,故B正确;
C、冰醋酸属于弱电解质,加水促进电离,冰醋酸中逐滴加水,溶液的导电性先增大后减小,pH先减小后增大,醋酸的电离程度逐渐增大,故C错误;
D、NaHCO3存在物料守恒,即c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故D错误;
故选B.
点评 本题考查弱电解质的电离、电离平衡常数、盐的水解,题目难度不大,注意把握弱电解质的电离特点以及影响电离平衡常数的因素.


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
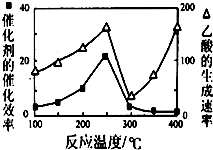 利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:
利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
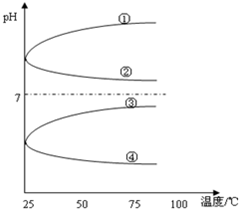 A、B、C、D、E五种溶液分别为NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别为NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
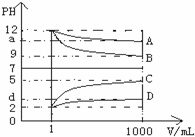
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O的电离平衡常数随着温度升高而减小 | |
| B. | 在0.10 mol•L-1CH3COOH溶液中,加入少量CH3COONa晶体后,溶液的pH减小 | |
| C. | 强酸、强碱和大部分盐类都是强电解质,其他化合物都是弱电解质 | |
| D. | 相同温度下,醋酸溶液的导电能力可能比稀硫酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同浓度的两溶液中c(OH-) 相同 | |
| B. | pH=13的两溶液稀释100倍,pH都为11 | |
| C. | 100 mL 0.1 mol/L的两溶液能中和等物质的量的盐酸 | |
| D. | 两溶液中分别加入少量对应的硫酸盐固体,c(OH-) 均明显减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
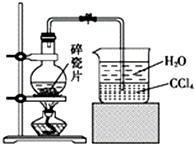 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.| 反应物 | NaBr | 98.3% 浓H2SO4 | 异戊醇 | 水 |
| 用量 | 0.30mol | 35mL(过量) | 0.25mol | 30mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com