
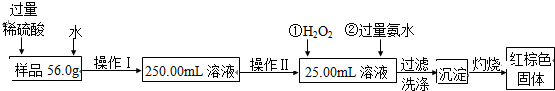


科目:高中化学 来源: 题型:
289 115 |
285 113 |
| A、115号元素变成113号元素是化学变化 | ||||
B、
| ||||
C、
| ||||
| D、113号元素位于周期表第8周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在实验室中,制得纯净的气体,往往需要对气体进行干燥,某同学用如图所示装置干燥铁粉与水蒸气在高温条件下反应所得的H2,在干燥管中加入CaO固体,干燥后的H2点不燃,通过测定,发现是CaO固体变质导致的.
在实验室中,制得纯净的气体,往往需要对气体进行干燥,某同学用如图所示装置干燥铁粉与水蒸气在高温条件下反应所得的H2,在干燥管中加入CaO固体,干燥后的H2点不燃,通过测定,发现是CaO固体变质导致的.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O3+2KI+H2O═2KOH+I2+O2 |
| B、2CH3COOH+Ca(CIO)2═2HClO+(CH3COO)2Ca |
| C、I2+2NaClO3═2NalO3+Cl2 |
| D、4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
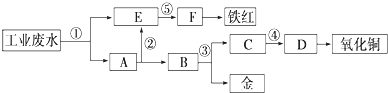
查看答案和解析>>
科目:高中化学 来源: 题型:
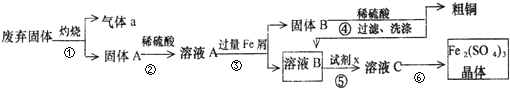
查看答案和解析>>
科目:高中化学 来源: 题型:
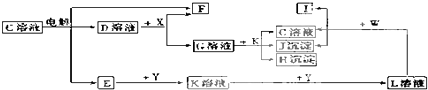
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com