
【题目】已知 A、B、C、D、E、F 是六种短周期主族元素,原子序数依次增大。A、C、F 的单质在常温下呈气态,B 的原子最外层电子数是其电子层数的 2 倍,A 与 D 同主族,C 的气态氢化物能与其最高价氧化物的水化物反应,E 是地壳中含量最高的金属元素。清回答下列问题:
(1)F 的元素符号为______,B、C、D、E 四种元素原子半径由大到小的顺序是(写元素符号)_____。
(2)B 在元素周期表中的位置为_____,B 与硫元素形成的二元化合物的电子式为_____。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)_____。
(4)由 A,C,F 组成的一种常见的盐中结构中包含_____(选填“离子键”“极性键”和“非极性键”)
(5)单质 B 和元素 C 的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为______。
【答案】Cl Na>Al>C>N 第二周期第ⅣA族 ![]() HClO4 离子键 极性键 C+4HNO3(浓)
HClO4 离子键 极性键 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
【解析】
C 的气态氢化物能与其最高价氧化物的水化物反应,则C为N元素;E 是地壳中含量最高的金属元素,则E是是Al元素;A、B、C、D、E、F六种短周期主族元素原子序数依次增大,B 的原子最外层电子数是其电子层数的 2 倍,则B是C元素;A、C、F 的单质在常温下呈气态,则A为H元素、F为Cl元素;A 与 D 同主族,则D为Na元素。
(1)F为Cl元素;同周期元素从左到右,原子半径依次减小,同主族元素,从上到下原子半径依次增大,则C、N、Na、Al四种元素原子半径由大到小的顺序是Na>Al>C>N,故答案为:Cl;Na>Al>C>N;
(2)B是C元素,位于周期表第二周期ⅣA族;碳元素与硫元素形成的二元化合物的化学式为CS2,都是为![]() ,故答案为:第二周期ⅣA族;
,故答案为:第二周期ⅣA族;![]() ;
;
(3)元素非金属性越强,最高价氧化物对应的水化物酸性越强,A、B、C、D、E、F六种短周期主族元素中Cl元素非金属性最强,则Cl元素的最高价氧化物对应的水化物HClO4的酸性最强,故答案为:HClO4;
(4)A为H元素、C为N元素、F为Cl元素,三者组成的铵盐为氯化铵,氯化铵中铵根离子和氯离子形成离子键,铵根离子中N原子和氢原子形成极性共价键,故答案为:离子键和极性键;
(5)单质 B为碳,C 的最高价氧化物对应水化物为硝酸,碳单质和浓硝酸共热反应生成二氧化碳、二氧化氮和水,反应的化学方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是
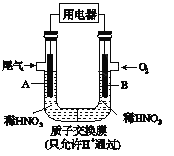
A. 电极A表面反应之一为NO2-e-+H2O= NO3_+2H+
B. 电极B附近的c(NO3_)增大
C. 电解质溶液中电流的方向由B到A,电子的流向与之相反
D. 该电池工作时,每转移4mol电子,消耗22.4L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】373K时把0.24 mol无色的N2O4气体通入体积500 mL的密闭容器中,发生反应:N2O4![]() 2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.04 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算:(本小题要求写出解过程)
2NO2,容器中立即出现红棕色。反应进行到2s时,测得生成NO2的物质的量为0.04 mol;反应进行到60 s时达到平衡,此时容器内N2O4与NO2的物质的量相等。请计算:(本小题要求写出解过程)
①开始2 s内以N2O4表示的化学反应速率______;
②达到平衡时体系的压强与开始时体系的压强之比______;
③N2O4的平衡转化率______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于 LDH(一种固体催化剂) 合成 NH3 的原理示意图,化学方程式为 2N2+6H2O=4NH3+3O2。下列说法不正确的是()
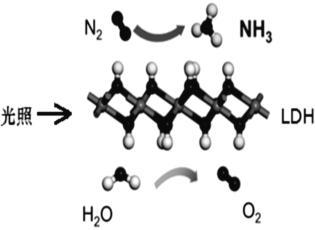
A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及共价键的断裂与生成
C. 氧化产物与还原产物的物质的量之比为 4∶3
D. 2molN2 与足量水充分反应,能制得氨气 4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCTV在“新闻30分”中介绍:王者归“铼”,我国发现超级铼矿,飞机上天全靠它。铼的稳定硫化物有ReS2,稳定的氧化物有Re2O7。工业上,常从冶炼铜的废液中提取铼,其简易工艺流程如下(部分副产物省略,铼在废液中以ReO4-形式存在):
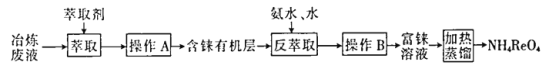
回答下列问题:
(1)NH4ReO4(高铼酸铵)中铼元素化合价为_________________。
(2)操作A的名称是_____________。
“萃取”中萃取剂应具有的性质:______(填代号)。
①萃取剂难溶于水 ②萃取剂的密度大于水
③ReO4-在萃取剂中的溶解度大于在水中的溶解度 ④萃取剂不和ReO4-发生反应
(3)在“反萃取”中,加入氨水、水的目的是_________________。
(4)在高温下高铼酸铵分解生成Re2O7,用氢气还原Re2O7,制备高纯度铼粉。
①写出高铼酸铵分解生成Re2O7的化学方程式_____________________。
②工业上,利用氢气还原Re2O7制备铼,根据生成铼的量计算氢气量,实际消耗H2量大于理论计算量,其原因是_____________________。
(5)工业上,高温灼烧含ReS2的矿粉,可以制备R2O7。以含ReS2的矿石原料生产48.4tRe2O7,理论上转移__________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Mg、Al、Zn组成的混合物与足量的盐酸作用,放出H2的体积为2.8L(标准状况下),则这三种金属的物质的量之和可能为
A. 0.250mol B. 0.100mol C. 0.125mol D. 0.080mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3+6HCl=3Cl2+KCl +3H2O,
③2KBrO3+Cl2=Br2+ 2KClO3,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C. 反应②中还原剂与氧化剂的物质的量之比为6:1
D. ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是学习化学的一种重要思想,下列关于物质的分类组合正确的是( )
分类组合 | 酸 | 碱 | 盐 | 酸性氧化物 | 碱性氧化物 |
A | 盐酸 | Na2CO3 | K2CO3 | CO2 | CaO |
B | 硝酸 | Ca(OH)2 | NaHSO4 | MgO | CO |
C | 硫酸 | 烧碱 | NaHCO3 | P2O5 | Na2O |
D | H2CO3 | Na2CO3 | CaCO3 | SO2 | CuO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,B、 D是中学化学常见金属,D在生活中应用最广泛。

(1)写出物质A与盐酸反应的离子方程式_____。
(2)探究A和B反应后固体的性质:将反应后容器中的残余固体置于烧杯中,加入100mL稀硝酸,固体完全溶解, (假设固体全部溶解后溶液体积不变),反应过程中无气体放出 (活泼金属可把稀HNO3还原为NH4NO3)。向反应后的溶液中缓慢滴加4mol·L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积的关系如图所示:
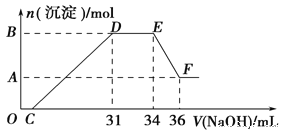
①写出DE段发生反应的离子方程式:_____。
②B与A的差值为_____mol。
③求c(HNO3)=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com