
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
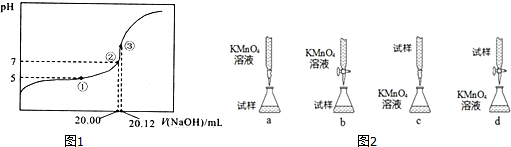
分析 (1)强碱滴定弱酸,达到终点时生成强碱弱酸盐,显碱性应选择酚酞做指示剂;
(2)(3)根据③中物料守恒计算醋酸浓度,再根据pH=pKa-lgc(CH3COO-)/lgc(CH3COOH)计算电离平衡常数;
(4)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)滴定实验是利用沉淀变色指示反应沉淀完全,在氯化银刚好沉淀完成,再滴加硝酸银溶液,与指示剂作用生成不同现象来进行判断;测定水体中氯化物的含量,必须使氯离子完全生成白色沉淀,指示沉淀反应完全的试剂溶解性一定小于氯化银,所以本题应在Ag+和Cl-生成AgCl沉淀后,再生成不同颜色沉淀指示沉淀终点.则指示剂的溶解度应比AgCl大来分析判断;
(6)高锰酸钾具有强的氧化性,能腐蚀碱式滴定管的橡胶管,应用酸式滴定管盛放,滴定时为便于观察颜色变化,滴定终点颜色由浅变深容易观察;滴入最后一滴KMnO4溶液恰好由棕黄色变紫色,且半分钟内不变色即达到终点;
解答 解:(1)强碱滴定弱酸,达到终点时生成强碱弱酸盐,显碱性应选择酚酞做指示剂;
故答案为:酚酞;
(2)(3)根据③中物料守恒得醋酸浓度=$\frac{0.02012L×0.1mol/L}{0.020L}$=0.1006mol/L,A为缓冲溶液,pH=pKa-lgc(CH3COO-)/lgc(CH3COOH),5=pKa-lg2,10-5=$\frac{Ka}{2}$,Ka=2×10-5,
故答案为:2×10-5;0.1006 mol/L;
(4)A、碱式滴定管未用标准溶液润洗,导致标准液浓度降低,消耗的标准液体积偏大,溶液浓度偏高,故A选;
B、锥形瓶未用待测液润洗,对消耗标准液体积不会产生影响,溶液浓度不变,故B不选;
C、滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了,导致消耗的标准液体积偏大,溶液浓度偏高,故C选;
D、滴定前,滴定管中的溶液液面最低点在“0”点以下,对消耗标准液体积不会产生影响,溶液浓度不变,故D不选;
故选:AC;
(5)A.氯化银、溴化银、碘化银的组成都是1:1,依据Ksp可以直接比较溶解性大小为氯化银>溴化银>碘化银;随Ksp的减小,应先出现碘化银沉淀、再出现溴化银,最后才沉淀氯化银;所以不符合滴定实验的目的和作用,不能测定氯化物的含量,故A错误;
B.依据A分析可知碘化银优先于氯化银析出,不能测定氯化物的含量,故B错误;
C.硫化银的Ksp很小,Ksp=[Ag+]2[S2-]=2.0×10-48,计算得到需要的银离子浓度[S2-]=$\root{3}{\frac{2.0×10{\;}^{-48}}{4}}$
Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10,[Cl-]=$\sqrt{1.8×10{\;}^{-10}}$,通过计算得出硫化银也比氯化银先沉淀,故C错误;
D.铬酸银的阳、阴离子个数比为2:1,可以计算相同浓度的银离子沉淀氯离子、铬酸根离子需要的浓度,依据Ksp计算得到,Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10,Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=2.0×10-12,[Cl-]=$\sqrt{1.8×10{\;}^{-10}}$,[CrO42-]=$\root{3}{\frac{2.0×10{\;}^{-12}}{4}}$;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4,做指示剂可以正确的测定氯化物的含量,故D正确.
故选:D;
(6)高锰酸钾具有强的氧化性,能腐蚀碱式滴定管的橡胶管,应用酸式滴定管盛放,滴定时为便于观察颜色变化,滴定终点颜色由浅变深容易观察,应将高锰酸钾滴到待测液中,滴入最后一滴KMnO4溶液恰好由棕黄色变紫色,且半分钟内不变色;
故选:b;滴入最后一滴KMnO4溶液恰好由棕黄色变紫色,且半分钟内不变色.
点评 本题综合题考查了中和滴定、氧化还原滴定实验,难溶电解质的溶解平衡的计算,为高频考点,明确中和滴定、氧化还原滴定原理,熟悉有关沉淀平衡理论是解题关键,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,难度中等.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原氨水的浓度为10-3mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含20.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.65kJ | |
| B. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则标况下1mol氢气完全燃烧放出241.8 kJ的热量 | |
| C. | 已知2C(s)+2O2(g)=2CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g)△H=b kJ•mol-1,则a>b | |
| D. | 已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.
某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.| 实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 22.00 |
| 2 | 20.00 | 22.10 |
| 3 | 20.00 | 21.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.3410-6 | 7.110-7 | 1.110-8 | 6.510-5 | 1.010-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
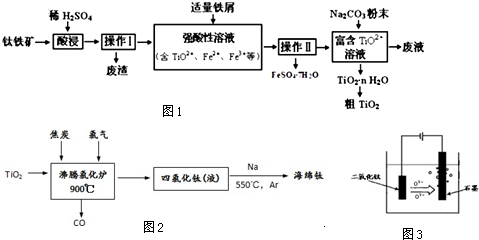
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
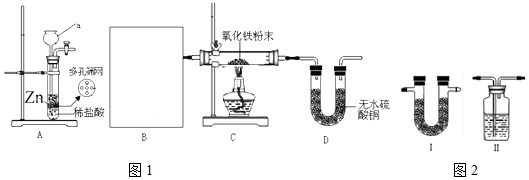
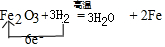 .实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.
.实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com