
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1mol/L、c2mol/L,则时间间隔t1min~t2min内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$mol/L•min |
分析 A.根据催化剂可以同等程度的增大正逆反应的反应速率;
B.增加压强不一定能增加反应速率,必须是提高反应物浓度(例如压缩体积),像充入惰性气体这样的方式,虽然增加了压强,但是反应速度依然不变;
C.该反应是放热反应,降低温度反应速率减慢;
D.根据v=$\frac{△c}{△t}$计算判断.
解答 解:A、催化剂可同等程度的改变正、逆反应的反应速率,故A错误;
B、若在恒容条件下,向容器通入惰性气体,反应体系的压强变大,但反应各物质的浓度不变,因此反应速率也不变,故B正确;
C、该反应是放热反应,降低温度反应速率减慢,达平衡所需时间增加,故C错误;
D、根据计算平均速率的定义公式,浓度变化量c2-c1,时间为t2-t1,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$mol/L•min,故D正确;
故选:BD.
点评 本题主要考查化学反应速率与化学平衡的影响的因素,化学反应速率计算等,B选项为易错点,注意理解压强对反应速率、化学平衡的影响,改变压强影响物质的浓度.


科目:高中化学 来源: 题型:多选题
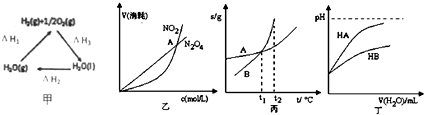
| A. | 甲中△H1=-(△H2+△H3) | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于等物质的量浓度的NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
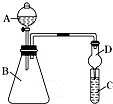 某同学欲利用图装置验证同主族元素性质递变规律.
某同学欲利用图装置验证同主族元素性质递变规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15L | B. | 20L | C. | 23L | D. | 24L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性高锰酸钾溶液、溴水 | B. | 酸性高锰酸钾溶液、碳酸钠溶液 | ||
| C. | 酸性高锰酸钾溶液、氢氧化钠溶液 | D. | 酸性高锰酸钾溶液、氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何可逆反应都有一定的限度 | |
| B. | 化学反应达到平衡状态时,正、逆反应速率相等 | |
| C. | 化学反应达到平衡状态与时间的长短无关 | |
| D. | 化学平衡状态是不可改变的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com