
有以下物质:
①6 g H2;②0.5 mol CO2;③1.204×1024个HCl分子;④147 g H2SO4;⑤4 ℃时27 mL水。
(1)它们的物质的量最大的是________。(填序号,下同)
(2)所含分子数最多的是________。
(3)所含原子数最多的是________。
(4)质量最小的是________。
解析: 各物质的物质的量分别为:n(H2)=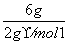 =3 mol,n(CO2)=0.5 mol,n(HCl)=
=3 mol,n(CO2)=0.5 mol,n(HCl)=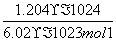 =2 mol,n(H2SO4)=
=2 mol,n(H2SO4)=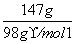 =1.5 mol,n(H2O)=
=1.5 mol,n(H2O)=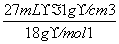 =1.5 mol。故①物质的量最大,分子数最多;①~⑤中原子的物质的量依次为6 mol、1.5 mol、4 mol、10.5 mol、4.5 mol,故④中原子数最多;各物质的质量依次为:m(H2)=6 g,m(CO2)=0.5 mol×44 g·mol-1=22 g,m(HCl)=2 mol×36.5 g·mol-1=73 g,m(H2SO4)=147 g,m(H2O)=27 g,故①的质量最小。
=1.5 mol。故①物质的量最大,分子数最多;①~⑤中原子的物质的量依次为6 mol、1.5 mol、4 mol、10.5 mol、4.5 mol,故④中原子数最多;各物质的质量依次为:m(H2)=6 g,m(CO2)=0.5 mol×44 g·mol-1=22 g,m(HCl)=2 mol×36.5 g·mol-1=73 g,m(H2SO4)=147 g,m(H2O)=27 g,故①的质量最小。
答案: (1)① (2)① (3)④ (4)①


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
反应FeO(s)+C(s)=Fe(s)+CO(g) △H>0,ΔS>0,下列说法正确的是
A.低温下自发进行,高温下非自发进行 B.高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行 D.任何温度下均为自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
A.3∶2∶1 B.2∶4∶1 C.2∶3∶1 D.4∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示。
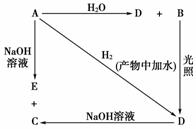
(1)请分别写出A、B、C、D、E的化学式(如为溶液请填溶质的化学式):
A________、B________、C________、D________、E________。
(2)写出下列反应的化学方程式:
A+H2O:_________________________________________________;
A+NaOH:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设一个12C原子的质量为a g,一个R原子的质量为b g,阿伏加德罗常数为NA mol-1,则R的相对原子质量可以表示为( )
①12a/b ②12b/a ③bNA ④aNA
A.①③ B.①④
C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
21世纪新材料是高新技术的突破口,只有更好地开发和应用具有特殊性能的新材料,才能拥有更强大的经济实力和技术潜力。下列各学科,对于新材料的开发和研制最具有独特优势的是( )
A.物理 B.化学 C.地理 D.生物
查看答案和解析>>
科目:高中化学 来源: 题型:
H2SO4和HNO3的浓度分别为4mol/L和2mol/L的混合液,取10mL加入过量的铁粉,若HNO3的还原产物为NO,则生成气体在标况下的总体积为 ( )
A.0.224L B.0.672L C.0.112L D.0.336L
查看答案和解析>>
科目:高中化学 来源: 题型:
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
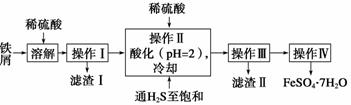
查询资料,得有关物质的数据如下表:
| 25 ℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
(1)操作Ⅱ中,通入硫化氢至饱和的目的是____________;在溶液中用硫酸酸化至pH=2的目的是_______________________________________________________。
(2)操作Ⅳ的顺序依次为蒸发浓缩、冷却结晶、___________________________。
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②________________________________________________________。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850 g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①滴定时盛放KMnO4溶液的仪器为________(填仪器名称)。
②判断此滴定实验达到终点的方法是_____________________________________。
③计算上述样品中FeSO4·7H2O的质量分数为_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com