
 E的氢化物的电子式
E的氢化物的电子式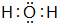 .
.分析 A、B、C、D、E五种短周期元素,A是非金属性最强的元素,故A为F元素;D的气态氢化物的水溶液呈碱性,而其最高价氧化物的水化物为强酸,则D为N元素;E元素原子的最外层电子数比次外层电子数多4个,原子只能有2个电子层,最外层电子数为6,故E为O元素;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍,故C是H元素;A与B可形成BA型化合物,则B表现+1价,处于IA族,金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个,则B为Na,据此解答.
解答 解:(1)A、B、C、D、E五种短周期元素,A是非金属性最强的元素,故A为F元素;D的气态氢化物的水溶液呈碱性,而其最高价氧化物的水化物为强酸,则D为N元素;E元素原子的最外层电子数比次外层电子数多4个,原子只能有2个电子层,最外层电子数为6,故E为O元素;C元素有三种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍,故C是H元素;A与B可形成BA型化合物,则B表现+1价,处于IA族,金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个,则B为Na,
故答案为:氟;钠;氢;氮;硫;
(2)C为H元素,则C1、C2、C3三种原子分别为氢元素的三种核素:11H、12H、13H,故答案为:11H、12H、13H;
(3)E为O元素,E2-离子为氧离子,核电荷数为8,最外层达到8电子稳定结构,其离子结构示意图为 ,其氢化物为H2O,电子式为
,其氢化物为H2O,电子式为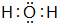 ,
,
故答案为: ;
;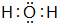 ;
;
(4)氟气与Na单质反应的化学方程式:F2+2Na=2NaF,故答案为:F2+2Na=2NaF;
(5)氟气与反应反应方程式为:2F2+2H2O=4HF+O2,Na与水反应方程式为:2Na+2H2O=4NaOH+O2↑,将反应后生成的溶液混合,发生反应的离子方程式为:HF+OH-=F-+H2O,
故答案为:2F2+2H2O=4HF+O2;2Na+2H2O=4NaOH+O2↑;HF+OH-=F-+H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向煮沸的1mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| B. | 用氢氧化铜粉末检验尿糖 | |
| C. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| D. | 用醋和澄清石灰水验证蛋壳中含有碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是700 mL | |
| B. | 该合金中铜与镁的物质的量之比是2:1 | |
| C. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l);△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l);△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g);△H=-817.63 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S2O3与硫酸反应的实验中,实验室没有硫酸,临时用硝酸进行实验 | |
| B. | 滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 | |
| C. | 制取氯气时,用二氧化锰与浓盐酸在加热下反应,并用排水集气法收集 | |
| D. | 配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,用水稀释到所需浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液. ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | ①出现白色沉淀. ②无明显现象 | 白色物质为Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com