
2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(3)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
A.2F2+2H2O=4HF+O2 B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑ D.3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为 ,反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8 L饮用水时,电池内转移的电子数约为 。
【知识点】离子共存、氧化剂和还原剂的判断、原电池中电极反应的书写、转移电子数目的计算
【答案解析】 (1) 略(2分) (2)①③ (2分)
(3)CD(2分) B(1分)
(4)H2 +2OH - -2e =2H2O(2分) 200NA (2分)
解析:(1)略
(2)pH=1的水溶液中含有大量的H+,①中的离子不会发生反应,可以共存;②中的NO3-在酸性的条件下可以把Fe2+氧化,故不能共存;③中的离子不会发生反应,可以共存;④中HCO3-在酸性的条件下生成CO2,故不能共存。
(3)A、水中的氧元素的化合价由-2价变到0价,化合价升高,失去电子,做还原剂;B、水中元素化合价都没有发生改变,既不做氧化剂又不做还原剂;C、水的氢元素的化合价由+1价变到0价,化合价降低,得到电子,做氧化剂;D、水的氢元素的化合价由+1价变到0价,化合价降低,得到电子,做氧化剂。
(4)燃料电池中负极是氢气失去电子的反应故负极电极反应为H2 +2OH - -2e =2H2O。
电池总反应为2H2 +O2 =2H2O
n(H2O)= 1.8 ×103/18=100mol,在总反应中生成2mol水转移的电子的物质的量为4mol,故生成100mol水时转移的电子的物质的量为200mol,约为200NA。
【思路点拨】本题考查了在前提条件下的离子共存,氧化剂和还原剂的判断,在氢氧碱性燃料电池中的电极反应的书写,把在每一个知识点中容易出错的都放在一个试题中,使试题的难度加大。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol NaHSO4晶体中离子总数为3NA
B.2.24 L 14CH4分子中所含中子数为0.8NA
C.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
D. 常温常压下,16gO2和O3混合气体含有NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近溶液呈红色。请回答:
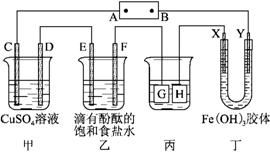 |
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为___________________________________。
(3)现用丙装置给铜件镀银,则H应该是_______________(填“镀层金属”或“镀件”),电镀液是______________溶液。当乙中溶液的pH=13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为___________________。
(4)丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明__________________________,在电场作用下向Y极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
金刚石和石墨是碳元素的两种结构不同的单质(同素异形体)。在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能。据此,试判断在100kPa压强下,下列结论正确的是
A.石墨比金刚石稳定
B.金刚石比石墨稳定
C.1mol石墨比1mol金刚石的总能量高
D.1mol石墨和1mol金刚石的总能量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:
A(s)+2B(g) C(g)+D(g) 已达平衡的是
C(g)+D(g) 已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.生成l mol C的同时生成l mol D D.气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列给定条件的各溶液中,一定能大量共存的离子组是( )
A.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、SCN-、NO3-
B.室温下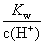 =10-13 mol·L-1的溶液中:NH4+、Mg2+、NO3-、SO42-
=10-13 mol·L-1的溶液中:NH4+、Mg2+、NO3-、SO42-
C.加入Al能放出H2的溶液中:NH4+、K+、Cl-、HCO3-
D.在H+、Na+、SO42-浓度均为0.1 mol·L-1的溶液中:K+、SiO32-、Cl-、CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是( )
A. 当有0.1mol电子转移时,a极产生1.12L O2(标准状况下)
B. b极上发生的电极反应是:4H2O + 4e- = 2H2↑+ 4OH-
C. d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O
D. c极上进行还原反应,B中的H+可以通过隔膜进入A
查看答案和解析>>
科目:高中化学 来源: 题型:
“纳米技术”广泛的应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是
A.能全部通过半透膜 B.能发生丁达尔现象
C.一定能导电 D.一定为悬浊液或乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其解释不正确的是
A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3
B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气
C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com