
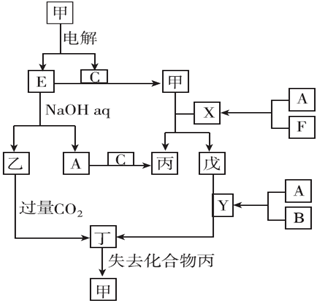
分析 A、B、C、D、E、F是中学化学常见的六种单质,原子序数依次增大的短周期主族元素,六种元素都不在同一主族,电解甲到得到单质E与气体单质C,E能与氢氧化钠溶液反应生成乙与气体单质A,则E为Al、乙为NaAlO2、A为H2、甲为Al2O3、C为O2,由转化关系可知,丁为Al(OH)3,丙为H2O,F的原子序数大于Al,则F为Cl2,B的原子序数小于氧元素,且单质为气体,故B为N2,D与H、Cl不在同一主族,原子序数小于Al,大于氧,故D为Mg,则X为HCl、Y为NH3、戊为AlCl3,据此解答.
解答 解:A、B、C、D、E、F是中学化学常见的六种单质,原子序数依次增大的短周期主族元素,六种元素都不在同一主族.电解甲到得到单质E与气体单质C,E能与氢氧化钠溶液反应生成乙与气体单质A,则E为Al、乙为NaAlO2、A为H2、甲为Al2O3、C为O2,由转化关系可知,丁为Al(OH)3,丙为H2O,F的原子序数大于Al,则F为Cl2,B的原子序数小于氧元素,且单质为气体,故B为N2,D与H、Cl不在同一主族,原子序数小于Al,大于氧,故D为Mg,则X为HCl、Y为NH3、戊为AlCl3.
(1)由上述分析可知.甲为氧化铝,乙为偏铝酸钠,故答案为:氧化铝;偏铝酸钠;
(2)实验室制取F(氯气)的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,检验氯气收集满的方法:将湿润的KI淀粉试纸放在集气瓶口,试纸变蓝证明氯气收集满,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;将湿润的KI淀粉试纸放在集气瓶口,试纸变蓝证明氯气收集满;
(3)氨气和CuO的反应方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(4)偏铝酸钠和过量CO2反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)Mg和Al形成原电池的两个电极,NaOH溶液是电解质溶液,Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,Al为负极,Mg为正极,负极电极反应式为:Al+4OH--3e-=AlO2-+2H2O,
故答案为:负极;Al+4OH--3e-=AlO2-+2H2O;
(6)73 g HCl物质的量为2mol,与足量的NaOH溶液反应放热Q kJ,1molHCl反应放出热量为0.5Q kJ,该反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-0.5Q kJ/mol,
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-0.5Q kJ/mol;
(7)D的最高价氧化物对应水化物Mg(OH)2的Ksp=1.8×10-11,该物质的溶液中,要使Mg2+离子 的浓度降至1.8×10-9 mol/L,则c(OH-)=$\sqrt{\frac{1.8×10{\;}^{-11}}{1.8×10{\;}^{-9}}}$mol/L=0.1mol/L,溶液中c(H+)=10-13mol/L=0.1mol/L,则溶液pH=-lg10-13=13,
故答案为:13.
点评 本题考查无机物推断,转化中E与氢氧化钠反应为推断突破口,熟练注意短周期元素,是对学生综合能力的考查,难度中等.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、OH-(5:2:4:4) | B. | NH4+、Ba2+、OH-、Cl-(1:1:1:2) | ||
| C. | Fe3+、Na+、Cl-、S2-(1:2:3:1) | D. | K+、H+、I-、NO3-(1:1:1:1) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
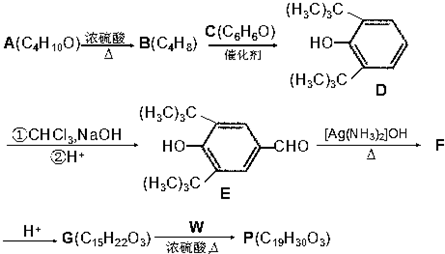
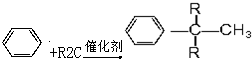 (R为烷基)
(R为烷基)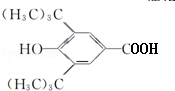 ;E中含有的官能团名称是羟基和醛基;
;E中含有的官能团名称是羟基和醛基;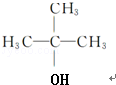 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;该反应类型为消去反应;
+H2O;该反应类型为消去反应;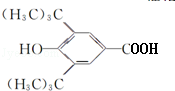 +CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2CH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$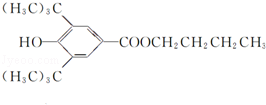 +H2O;该反应类型为酯化反应;
+H2O;该反应类型为酯化反应;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42g乙烯和丙烯的混合气体中碳原子数目一定为3NA. | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入 0.1 mol Cu(OH)2能使溶液复原,则电解时产生标准状况下1.12L的气体 | |
| C. | 配制一定物质的量浓度的NaOH溶液,把NaOH固体于烧杯中充分溶解,并迅速转移到容量瓶中定容 | |
| D. | 30g的NO与O2于密闭容器中充分反应,容器内的气体分子数为1 NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 N2H4(肼)可作用制药的原料,也可作火箭的燃料.(1)肼能与酸反应.N2H6Cl2溶液呈弱酸性,在水中存在如下反应:
N2H4(肼)可作用制药的原料,也可作火箭的燃料.(1)肼能与酸反应.N2H6Cl2溶液呈弱酸性,在水中存在如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,该反应
,该反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 | |
| B. | 用于新版人民币票面图案等处的油墨中所含的Fe3O4是一种磁性物质 | |
| C. | 双氧水、高锰酸钾溶液可以杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理不相同 | |
| D. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com