
| A. | 0.5mol/LNaCl溶液 | B. | 1L3mol/LNa2SO4溶液 | ||
| C. | 0.4mol/LNaOH溶液 | D. | 2L0.15mol/LNa3PO4溶液 |
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | X为负极、Y为正极 | |
| B. | 工作一段时间后,KOH的物质的量不变 | |
| C. | 在标况下通过5.6 L O2完全反应则有l.0 mol 电子发生转移 | |
| D. | 该电池工作时甲烷一极附近溶液 pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其分子的空间构型为三角锥型.
,其分子的空间构型为三角锥型.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 危险性 | 危险品 |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质,设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
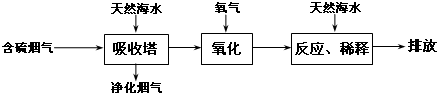
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的熔沸点比原任一金属要高 | B. | 合金的硬度比原任一金属要大 | ||
| C. | 非金属也可以是合金的成分之一 | D. | 合金的用途比纯金属的用途更广 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| A | NaHCO3溶液 | Na2CO3 | Ba(OH)2溶液 |
| B | Fe2O3 | Al2O3 | NaOH溶液 |
| C | FeCl3溶液 | CuCl2 | Fe |
| D | Na2SO4溶液 | Na2CO3 | 盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol双氢青蒿素的质量为284g?mol-1 | |
| B. | 双氢青蒿素的摩尔质量等于它的相对分子质量 | |
| C. | 14.2g双氢青蒿素中含有的原子总数为2.2NA | |
| D. | 含有6.02×1023个碳原子的双氢青蒿素的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
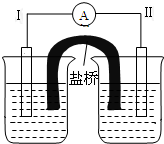 根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示.
根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com