
(11分)已知: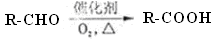
美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。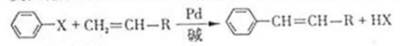
(X为卤原子,R为取代基)
经由Heck反应合成M(一种防晒剂)的路线如下: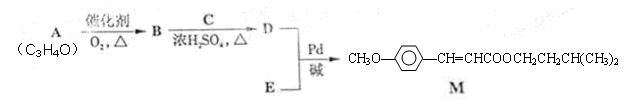
回答下列问题:
(1)M可发生的反应类型是______________。
a. 取代反应 b. 酯化反应 c. 消去反应 d. 加成反应
(2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是___ ____。
D在一定条件下反应生成高分子化合物G,G的结构简式是______ ____。
(3)在A→B的反应中,检验A是否反应完全的试剂是_____ __________。
(4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为_______ 。
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)已知:
美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。
(X为卤原子,R为取代基)
经由Heck反应合成M(一种防晒剂)的路线如下:
回答下列问题:
(1)M可发生的反应类型是______________。
a. 取代反应 b. 酯化反应 c. 消去反应 d. 加成反应
(2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是___ ____。
D在一定条件下反应生成高分子化合物G,G的结构简式是______ ____。
(3)在A→B的反应中,检验A是否反应完全的试剂是_____ __________。
(4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为_______ 。
查看答案和解析>>
科目:高中化学 来源:2013届河北正定中学高二下学期第一次考试化学试卷 题型:填空题
(11分)已知:
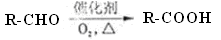
美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。
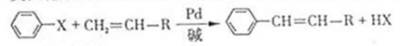
(X为卤原子,R为取代基)
经由Heck反应合成M(一种防晒剂)的路线如下:
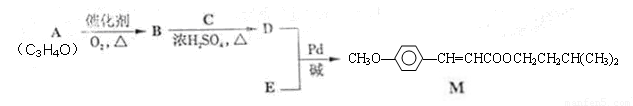
回答下列问题:
(1)M可发生的反应类型是______________。
a. 取代反应 b. 酯化反应 c. 消去反应 d. 加成反应
(2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是___ ____。
D在一定条件下反应生成高分子化合物G,G的结构简式是______ ____。
(3)在A→B的反应中,检验A是否反应完全的试剂是_____ __________。
(4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
共11分)2005年1月美国科学家在Science上发表论文,宣布发现了Al的超原子结构,并预言其他金属原子也可能存在类似的结构,这是一项将对化学、物理以及材料领域产生重大影响的发现,引起了科学界的广泛关注。这种超原子是在Al的碘化物中发现的,以13个Al原子或14个Al原子形成Al13或Al14超原子结构,量子化学计算结果表明,Al13形成12个Al在表面,1个Al在中心的三角二十面体结构,Al14可以看作是一个Al原子跟Al13面上的一个三角形的3个Al形成Al―Al键而获得的。文章还指出,All3和All4超原子都是具有40个价电子时最稳定。
(1) 根据以上信息可预测Al13和Al14的稳定化合价态分别为 和 。A114应具有元素周期表中 类化学元素的性质,理由是: 。
(2) 对Al13和A114的Al―Al键长的测定十分困难,而理论计算表明,Al13,和Al14中的Al―Al键长与金属铝的Al―Al键长相当,已知金属铝的晶体结构采取面心立方最密堆积,密度约为2.7g/cm3,请估算Al13和Al14:中Al―Al的键长。
。
(3) Al13三角二十面体中有多少个四面体空隙,假设为正四面体空隙,如果在其中搀杂其他原子,请通过计算估计可搀杂原子的半径最大为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com