
| A. | 决定某化学反应反应速率的主要因素是催化剂 | |
| B. | 青霉素、橡胶、阿斯匹林全部由化学合成制得 | |
| C. | 铝有还原性,在反应中放出大量热能用来冶炼难熔金属Mn等 | |
| D. | 陶瓷品、酒精、乙烯塑料等的使用不会对环境造成污染 |
分析 A、决定化学反应速率的主要因素是反应物本身的性质;
B、自然界有天然橡胶;
C、金属冶炼的本质是金属离子得电子被还原为单质;
D、陶瓷和乙烯塑料在自然界中不能降解.
解答 解:A、决定化学反应速率的主要因素是物质的性质,催化剂只是外界因素,故A错误;
B、自然界有天然橡胶,故橡胶不一定通过化学合成来制取,故B错误;
C、金属冶炼的本质是金属离子得电子被还原为单质,所以在冶炼金属方面,主要还是利用了铝的还原性,在铝热反应中放出大量热,故C正确;
D、陶瓷和乙烯塑料在自然界中不能降解,能造成污染,故D错误.
故选C.
点评 本题考查金属的冶炼和决定反应速率的主要因素,实质为金属之间的置换反应,注意铝热反应的原理及应用,题目难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
时间/min n(CH4)/mol 温度 | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.00 | 0.70 | 0.50 | 0.20 | 0.20 |
| T2 | 1.00 | 0.60 | 0.36 | … | 0.30 |
| A. | 10 min内,T1时的化学反应速率比T2时大 | |
| B. | 温度:T1<T2 | |
| C. | Q>0 | |
| D. | 化学平衡常数:K(T1)<K(T2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①②③④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其分子的空间构型为三角锥型.
,其分子的空间构型为三角锥型.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
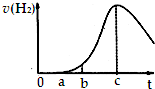 把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )| A. | 曲线由0→a段发生了氧化还原反应 | |
| B. | 曲线由b→c段,产生氢气的速率增加较快的主要原因是反应放热 | |
| C. | c点达到了平衡 | |
| D. | c点以后,反应逐渐消耗了产生的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 危险性 | 危险品 |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质,设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
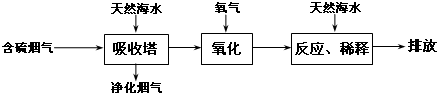
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| A | NaHCO3溶液 | Na2CO3 | Ba(OH)2溶液 |
| B | Fe2O3 | Al2O3 | NaOH溶液 |
| C | FeCl3溶液 | CuCl2 | Fe |
| D | Na2SO4溶液 | Na2CO3 | 盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com