
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/molE(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+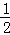 O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
C(s)+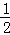 O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
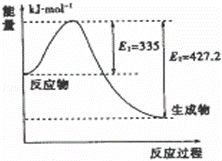
(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: .
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为 ;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2 2Q1(填“>”、“<”或“=”)
考点: 用盖斯定律进行有关反应热的计算;燃烧热;热化学方程式.
分析: (1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;
(2)依据反应焓变=反应物键能总和﹣生成物键能总和计算得到;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)①依据图象分析,生成2mol氨气反应焓变=断裂化学键吸收能量﹣形成化学键放出能量计算得到1mol氨气放出热量;
②依据化学平衡计算生成氨气物质的量,结合热化学方程式计算Q1,若在同体积的容器中充入2mol N2和6mol H2,可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行计算分析达平衡后放出的热量为Q2 kJ.
解答: 解:(1)在25℃、101kPa下,16g甲醇(CH3OH)燃烧生成CO2和液态水时放热352kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为704KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+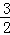 O2(g)=CO2(g)+2H2O(l)△H=﹣704kJ•mol﹣1,
O2(g)=CO2(g)+2H2O(l)△H=﹣704kJ•mol﹣1,
故答案为:CH3OH(l)+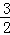 O2(g)=CO2(g)+2H2O(l)△H=﹣704kJ•mol﹣1;
O2(g)=CO2(g)+2H2O(l)△H=﹣704kJ•mol﹣1;
(2)焓变△H=反应物键能总和﹣生成物键能总和,H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/mol,E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol,
E(H﹣H)+E(Cl﹣Cl)﹣2E(H﹣Cl)=△H,
则E(H﹣Cl)=432 kJ/mol;
故答案为:432 kJ/mol;
(3)①2Cu(s)+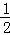 O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
②C(s)+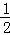 O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
③2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1
依据盖斯定律①+②﹣③得到工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5 KJ/mol;
故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5 KJ/mol;
(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335KJ/mol﹣427.2KJ/mol=﹣92.2KJ/mol,所以生成1mol氨气放热46.1KJ;
故答案为:46.1 kJ;
②如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335KJ/mol﹣427.2KJ/mol=﹣92.2KJ/mol,
N2(g)+3H2(g)=2NH3(g)△H=﹣92.2KJ/mol
1 3 0
0.2 0.6 0.4
生成0.4mol氨气放热=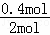 ×92,2KJ=18.44KJ;
×92,2KJ=18.44KJ;
若在同体积的容器中充入2mol N2和6mol H2,可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行达平衡后放出的热量Q2 大于2Q1;
故答案为:18.44,>;
点评: 本题考查了热化学方程式和盖斯定律的计算应用,反应键能计算费用焓变,图象分析理解,注意反应焓变的意义理解,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:
下列说法不正确的是()
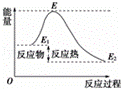
A. 反应物分子(或离子)间的每次碰撞是反应的先决条件
B. 反应物的分子的每次碰撞都能发生化学反应
C. 活化分子具有比普通分子更高的能量,催化剂能够减低活化能的数值
D. 活化能是活化分子的平均能量与所有分子平均能量之差,如图所示正反应的活化能为E﹣E1
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置中发生反应的离子方程式为:Zn+2H+═Zn2++H2↑,下列说法错误的是()

A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜﹣锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列热化学方程式分析,C(s)的燃烧热△H等于()
C(s)+H2O(l)=CO(g)+H2(g);△H1=+175.3kJ•mol﹣1
2CO(g)+O2(g)=CO2(g);△H2=﹣566.0kJ•mol﹣1
2H2(g)+O2(g)=2H2O(l);△H3=﹣571.6kJ•mol﹣1.
A. △H1+△H2﹣△H3 B. 2△H1+△H2+△H3
C. △H1+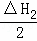 +△H3 D. △H1+
+△H3 D. △H1+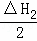 +
+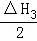
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室进行中和热测定的实验时除需要大烧杯(500mL)、小烧杯(100mL)外,所用的其他仪器和试剂均正确的一组是()
A. 0.50 mol•L﹣1盐酸,0.50 mol•L﹣1NaOH溶液,100 mL量筒1个
B. 0.50 mol•L﹣1盐酸,0.55 mol•L﹣1NaOH溶液,100 mL量筒2个
C. 0.50 mol•L﹣1盐酸,0.55 mol•L﹣1NaOH溶液,50 mL量筒1个
D. 0.50 mol•L﹣1盐酸,0.55 mol•L﹣1NaOH溶液,50 mL量筒2个
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是 ( )。
A.加热法只可软化暂时硬度的硬水
B.海水淡化的主要方法有蒸馏法和电渗析法等
C.反应2NaR+Ca2+===CaR2+2Na+的逆反应在一定条件下也能发生
D.硬水软化就是除净水中的Ca2+和Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
工厂的工业废水,不可直接往江河湖海中排放,否则会造成严重公害。某河道两旁有甲、乙两厂,它们排出的工业废水各含有K+、Fe3+、Ba2+、Ag+、Cl-、SO42-、NO3-、OH-中的四种。又知甲厂污水pH>7。
(1)甲厂污水中含有的四种离子可能是:_______________________________。
(2)乙厂污水中含有的四种离子可能是:______________________________。
(3)对乙厂废水进行处理,方法之一,可往废水中加入一定量的________(选填
“活性碳”“硫酸亚铁”或“铁粉”),可以回收其中的金属__________(填
元素符号)。
(4)消除污染的另一种重要措施是将甲、乙两厂的废水按比例混合,可使废水
中的________(填离子符号)转化为沉淀,从而大大降低污染程度。过滤后所
得废水主要含________,可用于浇灌农田。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与实验相关的叙述正确的是()
A. 将FeCl3稀溶液加热蒸发浓缩制备FeCl3的浓溶液
B. 做氢气还原氧化铜的实验是,应先通氢气后加热氧化铜
C. 稀释浓硫酸时,应将蒸馏水沿烧杯内壁缓慢地注入浓硫酸中并不断搅拌
D. 配制1 mol•L﹣1350mLNaCl溶液可以选择一个100mL的容量瓶和一个250 mL的容量瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com