
【题目】某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+ , 不能实现该反应的原电池组成是( )
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铂,负极为铁,电解质溶液为Fe2(SO4)3溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
科目:高中化学 来源: 题型:
【题目】无水三氯化铁呈棕红色、易潮解,在100 ℃左右时升华。设计如下实验,用来制取纯净、无水的FeCl3。

主要步骤:(1)加热浓盐酸和MnO2的混合物制取Cl2,请完成化学方程式:____________。
(2)________物质可净化Cl2,___________物质可干燥Cl2。
(3)净化干燥后的Cl2与Fe加热生成FeCl3
(4)过量的Cl2用NaOH溶液吸收,可制备________________。
【化学与生活】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是500 ℃时, 1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图。若在温度恒定,体积不变的容器中反应达到平衡,再充入NO2则,ΔH________(填“增大”、“减小”或“不变”,下同)。请写出NO2和CO反应的热化学方程式:__________。该反应能自发进行的主要原因为_____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】
2015年我国自主研制的C919大型客机正式下线,标志着我国成为世界上少数几个掌握研发制造大型客机能力的国家,同时意味着中国高端装备制造业发展到一个全新的高度。
(1)飞机的外壳通常采用镁、铝、钛合金材料,钛的价电子排布图为__________,第一电离能:镁 _________铝(填“大于”或“小于”)。
(2)Fe与CO能形成配合物羰基铁[Fe(CO)5],该分子中σ键与π键个数比为________。
(3)SCl2分子中的中心原子杂化轨道类型是_______,该分子构型为_________。
(4)已知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66pm和69 pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_____________。
(5)如图1所示,NiO晶胞中离子坐标参数A为(0,0,0),B为(1,0,1),则C离子坐标参数为___________。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图2),已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______g。(用a、NA表示)
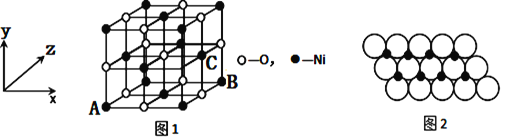
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关苯与乙烯的比较中,正确的是( )
A.分子中所有原子都在同一平面上
B.等质量燃烧时,苯耗氧多
C.都能与溴水反应
D.都能被酸性高锰酸钾溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023 , 则此时在阴极上析出铜的质量是( )
A.8g
B.16g
C.32g
D.64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、D、C、A、E五种元素的原子序数顺序依次增大,其中只有E为金属元素,D、C元素在元素周期表中位置相邻,在一定条件下,B的单质可以分别和A、C、D的单质化合生成甲、乙、丙化合物,C的单质和D的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10个电子,下图为相互转化关系:
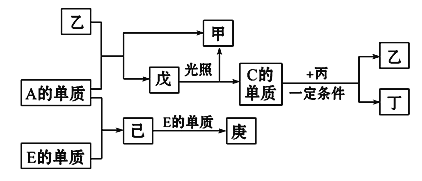
请回答下列问题:
(1)写出E的原子结构示意图_________________________。
(2)写出C、D氢化物的稳定性由强到弱的顺序____________。(用化学式表示)。
(3)A、B、D三种元素形成的化合物中,含有化学键的类型为___________。
(4)写出C与丙反应的化学反应方程式_________________________________。
(5)写出工业上从海水中制取A的离子反应方程式____________________________。
(6)工业上通过如下转化可制得含A元素的钾盐KAO3晶体:

①完成Ⅰ中反应的总化学方程式: ________
NaA+ H2O![]() NaAO3+
NaAO3+
②Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH4+):③>①
B. 水电离出的c(H+):②>①
C. ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A. 反应 CO2(g)+C(s)![]() 2CO(g)的 ΔS>0、ΔH<0
2CO(g)的 ΔS>0、ΔH<0
B. 体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率v逆::v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com