
下列各组离子能在pH=1的无色溶液中大量共存的是( )
|
| A. | Ba2+、Na+、I﹣、ClO﹣ | B. | Mg2+、Cl﹣、Al3+、SO42﹣ |
|
| C. | K+、Cl﹣、HCO3﹣、NO3﹣ | D. | Ca2+、Na+、Fe3+、AlO2﹣ |
| 离子共存问题. | |
| 分析: | pH=1的溶液中氢离子浓度为0.1mol/L,无色溶液中可排除 Cu2+、Fe2+、Fe3+、MnO4﹣等有色离子的存在, A.次氯酸根离子具有强氧化性,能够氧化碘离子,次氯酸根与氢离子反应生成次氯酸; B.Mg2+、Cl﹣、Al3+、SO42﹣之间不发生反应,都是无色离子,都不与氢离子反应; C.碳酸氢根离子与氢离子反应生成二氧化碳气体; D.铁离子为有色离子,且偏铝酸根离子与铁离子发生双水解反应,偏铝酸根离子与氢离子发生反应. |
| 解答: | 解:pH=1的溶液中氢离子浓度为0.1mol/L,溶液中存在大量氢离子;无色溶液中可排除 Cu2+、Fe2+、Fe3+、MnO4﹣等有色离子的存在, A.I﹣、ClO﹣之间发生氧化还原反应,ClO﹣与溶液中氢离子结合生成弱酸次氯酸,在溶液中不能大量共存,故A错误; B.Mg2+、Cl﹣、Al3+、SO42﹣之间不反应,都不与氢离子反应,且为无色溶液,在溶液中能够大量共存,故B正确; C.HCO3﹣与溶液中氢离子反应生成二氧化碳气体,在溶液中不能大量共存,故C错误; D.Fe3+、AlO2﹣之间发生双水解反应,Fe3+为有色离子,AlO2﹣还能与氢离子反应,在溶液中一定不能大量共存,故D错误; 故选B. |
| 点评: | 本题考查离子共存的正误判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN﹣)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH﹣;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4﹣等有色离子的存在. |


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
在10L恒容密闭容器中充入X( g)和Y(g),发生反应X(g)+Y(g)
g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡是,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
分别含有下列4种杂质的纯碱样品,当含杂质的质量分数相同时,取等质量的四种样品,与浓度相同的盐酸反应,所消耗盐酸的体积由多到少的顺序是( )
杂质:①NaOH;②Ca(OH)2;③NaHCO3;④CaCO3.
|
| A. | ①②④③ | B. | ③④①② | C. | ②①④③ | D. | ④③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸,且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为.
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有 ,请写出该反应的离子方程式:
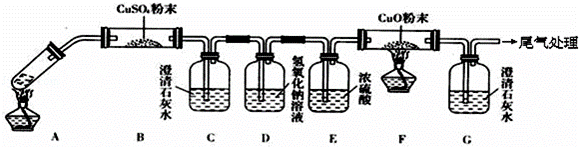
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红.据此回答:上述装置中,D的作用是 .乙二酸分解的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 含1 mol溶质的任何溶液,物质的量浓度一定相等 |
|
| B. | 配制1 mol/L NaCl溶液1 L,其方法是:将58.5 g NaCl溶于1 L水中即可 |
|
| C. | 体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数一定相同 |
|
| D. | 1 L 0.5 mol/L CaCl2溶液中,Ca2+与Cl﹣的物质的量浓度都是0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最少的是( )
|
| A. | Al | B. | Al(OH)3 | C. | AlCl3 | D. | Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。下面所列物质,贴错了包装标签的是: ( )
| 选项 | A | B | C | D |
| 物质 | 浓硫酸 | 汽油 | 酒精 | 氯酸钾 |
| 标签 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
用Na2CO3·10H2O固体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)本实验用到的仪器除托盘天平、烧杯、玻璃棒、胶头滴管外还需要 ,应称取Na2CO3·10H2O固体的质量:________。
(2)下列操作中,容量瓶所不具备的功能有 。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)配制0.2 mol·L-1的Na2CO3溶液480 mL的主要步骤有:①溶解②计算③转移洗涤 ④定容摇匀 ⑤称量;正确的操作顺序是: 。(填序号)
(4)根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
①Na2CO3·10H2O固体失去了部分结晶水
②用“左码右物”的称量方法称量固体(使用游码)
③碳酸钠固体不纯,其中混有氯化钠
④称量碳酸钠固体时所用砝码生锈
⑤容量瓶未经干燥使用
⑥定容摇匀后,发现液面低于刻度线,再加水至刻度。
⑦定容时仰视刻度线。
其中引起所配溶液浓度偏高的有________(填序号,下同),偏低的有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列说法正确的是________(选填序号)。
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.配制银氨溶液时,应把硝酸银溶液逐滴加入氨水中
C.一般在实验室点燃可燃性气体时,必须先要检验纯度
D.测定硫酸铜晶体结晶水的质量分数时,若用潮湿的坩埚会使测定结果偏小
E.酸碱中和滴定实验中根据碱式滴定管的两次读数得出NaOH溶液体积为22.0 mL
F.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
a.配制0.01 mol/L到0.008 mol/L等一系列浓度的[Fe(SCN)6]3-(红色)溶液作为标准比色液。
b.样品处理:
c.准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10 mL。
d.比色:选取与待测液颜色一致或相近的标准比色液即可判断待测液的浓度。
试回答下列问题:
①配制100 mL 0.01mol/L标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:________、________。
②步骤b脱色过程包括加入:________(填:脱有机色素的吸附剂名称)→搅拌→煮沸→冷却→________(填操作)。
③步骤b样品处理中,氧化的目的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com