
| A、此时水的离子积Kw=1×10-12 |
| B、水电离出的c(H+)=1×10-12mol/L |
| C、水的电离程度随温度升高而增大 |
| D、c(Na+)>c(SO42-) |
| 1×10-12 |
| 0.01 |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
| A、在含等物质的量的Ba(OH)2、KOH的混合溶液中缓慢通入CO2:Ba(OH)2、KOH、K2CO3、BaCO3 |
| B、在含等物质的量的FeBr2、FeI2的溶液中缓慢通入氯气:I-、Fe2+、Br- |
| C、在含等物质的量的[Al(OH)4]-、OH-、CO32-的溶液中逐滴加入盐酸:[Al(OH)4]-、Al(OH)3、OH-、CO32- |
| D、在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2,5-二甲基-3-乙基己烷的实验式:C5H11 |
B、芳香烃M的结构模型为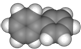 ,则M的结构简式为 ,则M的结构简式为  |
| C、纤维素三硝酸酯的分子式为(C6H7N3O11)n |
D、有机物 中所有原子有可能都在同一平面上 中所有原子有可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室制氢气的简易装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触,而稀硫酸又不够了.为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
如图为实验室制氢气的简易装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触,而稀硫酸又不够了.为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )| A、①②④ | B、②⑤⑥ |
| C、③④⑤ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液、萃取、蒸馏 |
| B、萃取、蒸馏、分液 |
| C、分液、蒸馏、萃取 |
| D、蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焚烧 |
| B、粉碎后深埋 |
| C、倾倒在海洋中 |
| D、用化学方法加工成防水涂料或汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时间/小时 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com