
 氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
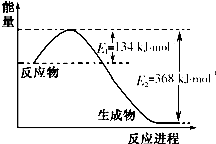
分析 (1)由图可知,1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)放出热量为368kJ-134kJ=234kJ,注明物质的聚集状态与反应热书写热化学方程式;
(2)已知:①N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
②2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746kJ•mol-1
根据盖斯定律,(①+②)÷2可得:CO(g)+$\frac{1}{2}$O2(g)═CO2(g);
(3)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
②若5分钟末达到平衡,此时测得体系压强是开始时的0.7倍,则平衡时混合气体总物质的量为(0.2+0.6)mol×0.7=0.56mol,利用差量法计算参加反应氢气的物质的量,进而计算氢气的转化率;
③正反应为放热反应,升高温度平衡逆向移动,平衡常数减小.
解答 解:(1)由图可知,1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)放出热量为368kJ-134kJ=234kJ,热化学方程式为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol;
(2)已知:①N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1
②2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746kJ•mol-1
根据盖斯定律,(①+②)÷2可得:CO(g)+$\frac{1}{2}$O2(g)═CO2(g),则△H=$\frac{1}{2}$×(180kJ•mol-1-746kJ•mol-1)=-283kJ•mol-1,
故答案为:-283;
(3)①N2(g)+3H2(g)?2NH3(g)的化学平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;
②若5分钟末达到平衡,此时测得体系压强是开始时的0.7倍,则平衡时混合气体总物质的量为(0.2+0.6)mol×0.7=0.56mol,则:
N2(g)+3H2(g)?2NH3(g)物质的量减小△n
3 2
0.36mol 0.8mol-0.56mol=0.24mol
故氢气的转化率为$\frac{0.36mol}{0.6mol}$×1005=36%,
故答案为:36%;
②正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故平衡常数K1>K2,
故答案为:>.
点评 本题考查化学平衡计算、平衡常数及影响因素、热化学方程式、盖斯定律应用等,(3)中计算注意差量法的应用,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
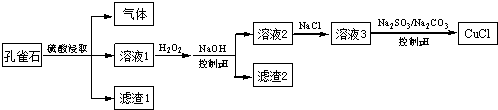
| A. | H2O2将溶液1中Fe2+氧化为Fe3+,再通过控制pH转化为Fe(OH)3除去 | |
| B. | SO32-将溶液3中的Cu2+还原,反应得到CuCl | |
| C. | CO32-作用是控制溶液pH,促使CuCl沉淀的生成 | |
| D. | 若改变试剂加入顺序,将溶液3缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | AlCl3 | C. | CaCl2 | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 30 | 40 | 50 | 60 |
| NH3生成量/10-6 mol | 4.8 | 5.9 | 6.0 | 6.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
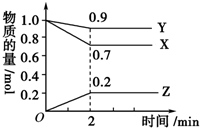 某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为Y+3X?2Z,反应开始至2min,X的转化率为30%.
某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为Y+3X?2Z,反应开始至2min,X的转化率为30%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 取某溶液少许,加入酸化的Ba(NO3)2溶液,产生白色沉淀 | 该溶液一定含SO42- |
| B | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| C | 某溶液加入盐酸产生使石灰水变浑浊的无色无味气体 | 该溶液肯定含HCO3-、CO32-中的一种或二种 |
| D | 测定等浓度的Na2CO3和Na2SO3溶液的pH;前者pH比后者的大; | 非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com