
常温下现有的四份溶液:
①0.01 mol/L HCl;②0.01 mol/L CH3COOH;③pH=12 的氨水;④pH=12的NaOH溶液。
下列说法正确的是
| A.②中由水电离出的c(H+)=1×10-12mol/L |
| B.将①、③混合,若有pH=7,则消耗溶液的体积:③>① |
| C.将②、④等体积混合(体积变化忽略不计),则c(CH3COO-)+c(CH3COOH)=0.01 mol/L |
| D.将四份溶液均稀释10倍后溶液pH:③>④,②<① |
科目:高中化学 来源: 题型:单选题
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述中正确的是( )
H++OH-,下列叙述中正确的是( )
| A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小 |
| C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,影响水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1 Na2SO4溶液,下列叙述正确的是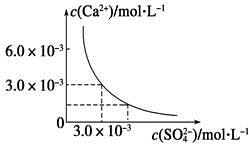
| A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小 |
| C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,0.1 mol·L-1某一元酸HA溶液中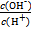 =1×10-12,下列说法中正确的是
=1×10-12,下列说法中正确的是
| A.溶液中由水电离出的c(H+)=1×10-10 mol·L-1 |
B.溶液中存在HA H++A- H++A- |
| C.与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 |
| D.原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,水存在H2O H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是
H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是
| A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 |
| B.将水加热,Kw增大,pH减小 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列水溶液一定呈中性的是( )
| A.c(NH4+)=c(Cl-)的NH4Cl溶液 |
| B.c(H+)=1.0×10-7 mol·L-1的溶液 |
| C.pH=7的溶液 |
| D.室温下将pH=3的酸与pH=11的碱等体积混合后的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关说法正确的是
| A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7 |
| B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
| C.pH=6的纯水中,c(OH-)=10-8 mol·L-1 |
| D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温时,将pH=3的CH3COOH溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应生成盐和水(若混合体积变化忽略不计),则下列有关所得混合液的说法正确的是
| A.混合后溶液pH=7 |
| B.所得混合溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.所得混合溶液中存在c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1 |
| D.混合后溶液中存在c(Na+)+c(H+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是
①稀释时,溶液中c(OH-)增大 ②溶液的pH<7 ③溶液中c(Na+)=c(A2-) ④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
| A.①②③④ | B.①③④ | C.①③ | D.②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com