
【题目】用氯气生产某些含氯有机物时会产生副产物氯化氢。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:①反应A中,4 mol氯化氢被氧化,放出115.6 kJ的热量。
②
(1)断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为________kJ,
(2)水分子中H—O键比氯化氢分子中H—Cl键(填“强”或“弱”)________。
【答案】32 强
【解析】
根据图示键能的大小及反应中成键断键情况和反应中能量变化分析计算键能的大小。
(1)在反应A中,若断开4 mol H-Cl键,则同时断开1 mol O=O键,形成2 mol Cl-Cl键和4 mol H-O键,此时反应放出的能量为115.6 kJ,由图可知,断开1 mol O=O键吸收的能量为1 mol×498 kJ·mol-1=498 kJ,形成2 mol Cl-Cl键放出的能量为2 mol×243 kJ·mol-1=486 kJ,二者的能量差为498 kJ-486 kJ=12kJ,则断开4 mol H-Cl键与形成4 mol H-O键的能量差为115.6 kJ+12 kJ=127.6 kJ,所以断开1 mol H-O键与断键1 mol H-Cl键所需的能量差约为![]() ,故答案为:32;
,故答案为:32;
(2)根据上述分析断开1 mol H-O键比断键1 mol H-Cl多消耗能量,所以水中H-O键比氯化氢中H-Cl键强,故答案为:强。


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请回答下列问题(提示B分液漏斗中为浓氨水,滴入烧瓶可产生氨气):
(1)装置的连接顺序是:(a)接________,________接________;(b)接________


(2)A中常选用的固体反应物为______________;D中应选用的液体为________________(填化学式)。
(3)第二步骤中必须先让__________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是______________________________,C中广口瓶内产生固体的总化学方程式为______________________ 。
(5)在第四步中分离NH4Cl晶体的操作是____________________(填操作名称);其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验证明所得固体的成分中含有Na+,简要写出操作和现象____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是
A.若生成2.24 L HF,则转移0.4 mol电子B.HF是氧化产物
C.O2F2既是氧化剂又是还原剂D.还原剂与氧化剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡状态的是( )
A.v正(NH3)=2v逆(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
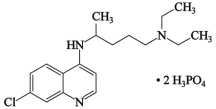
(1)C、N、O三种元素第一电离能从大到小的顺序为_____________;电负性χ(P)_____χ(Cl)(填“>”或“<”);
(2)磷酸氯喹中N原子的杂化方式为_____,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是___________;
(3)磷化镓与砷化镓是两种由ⅢA族元素与ⅤA族元素人工合成的Ⅲ-Ⅴ族化合物半导体材料。其晶胞结构可看作金刚石晶胞内部的碳原子被P(As)原子代替,顶点和面心的碳原子被Ga原子代替。
①基态Ga原子核外电子排布式为__________;
②砷化镓晶体中含有的化学键类型为___________(填选项字母);
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③磷化镓与砷化镓具有相似的晶体结构,其中熔点较高的是__________(填化学式),原因是_______________;
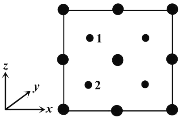
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为__________;若磷化镓的晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为__________ pm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(C4H10O)是一种有机溶剂,且A只有一种一氯取代物B,在一定条件下A可以发生如下变化:
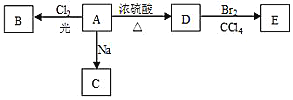
(1)A分子中的官能团名称是___,A的结构简式是___;
(2)写出下列化学方程式:
A→B:___;A→D:___;
(3)A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物燃料电池进行废水处理,实现碳氮联合转化。其工作原理如下图所示,其中M、N为厌氧微生物电极。
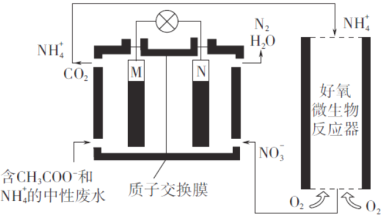
下列有关叙述错误的是
A. 负极的电极反应为CH3COO-—8e-+2H2O==2CO2↑+7H+
B. 电池工作时,H+由M极移向N极
C. 相同条件下,M、N两极生成的CO2和N2的体积之比为3:2
D. 好氧微生物反应器中发生的反应为NH3+2O2==NO3-+2H++H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com