
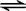 CH3COOH+OH-;
CH3COOH+OH-;分析 (1)根据能电离出醋酸根离子和钠离子的物质的组合情况来回答;
(2)醋酸钠中醋酸根离子能水解,导致溶液显示碱性;
(3)溶液呈碱性,则c(OH-)>c(H+),根据离子浓度关系和电离以及水解情况来回答;
(4)A、醋酸钠溶液中,钠离子浓度大于醋酸根浓度;
B、等浓度的CH3COONa和NaOH混合溶液中,钠离子浓度最大;
C.等浓度的CH3COONa和醋酸混合溶液中,醋酸的电离程度大于醋酸根离子的水解程度.
解答 解:(1)能电离出醋酸根离子的物质可以是醋酸和醋酸钠,能电离出钠离子的物质可以是氢氧化钠和醋酸钠,所以当溶液中含有Na+和CH3COO-在以及OH-、H+时,溶液中溶质的组成可以是:①CH3COONa、CH3COONa和CH3COOH、CH3COONa和NaOH,
故答案为:CH3COONa;CH3COONa和CH3COOH;CH3COONa和NaOH;
(2)醋酸钠中醋酸根离子能水解,导致溶液显示碱性,即CH3COO-+H2O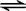 CH3COOH+OH-,
CH3COOH+OH-,
故答案为:CH3COO-+H2O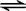 CH3COOH+OH-;
CH3COOH+OH-;
(3)当该溶液中溶质为两种,且溶液呈碱性时,溶液中的溶质组成可以为:氢氧化钠和醋酸钠(较多),此时存在c(Na+)>c(CH3COO-)>c(OH->c(H+),还可以是氢氧化钠和醋酸钠(较少),c(Na+)>c(OH-)>c(CH3COO-)>c(H+),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);c(Na+)>c(OH-)>c(CH3COO-)>c(H+);
(4)A、0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合后发生反应得到醋酸钠溶液,此时钠离子浓度大于醋酸根浓度,故A错误;
B、等浓度的CH3COONa和NaOH混合溶液中,c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故B错误;
C.等浓度的CH3COONa和醋酸混合溶液中,醋酸的电离程度大于醋酸根离子的水解程度,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确.
故答案为:C.
点评 本题考查离子浓度的大小比较以及弱电解质的电离等问题,题目难度较大,注意根据溶液离子浓度的关系结合弱电解质的电离和盐类的水解等知识解答.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | HAt很稳定 | B. | At是有色固体 | ||
| C. | At易溶于有机溶剂 | D. | AgAt不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 非金属原子间不可能形成离子键 | B. | 只有不同的原子间才能形成共价键 | ||
| C. | 共价化合物中不可能含离子键 | D. | 离子化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应达到化学平衡状态时,正、逆反应速率均等于零 | |
| B. | 当反应物与生成物浓度相等时,可逆反应一定已达到化学平衡状态 | |
| C. | 用锌粉代替锌粒与等浓度的稀硫酸反应,生成氢气的速率加快 | |
| D. | Fe与稀硫酸反应制取氢气时,改用浓硫酸可以增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
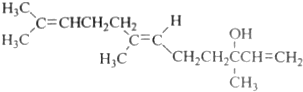
| A. | 橙花醇的分子式C15H26O | |
| B. | 橙花醇在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 橙花醇既能发生取代反应,也能发生加成反应和氧化反应 | |
| D. | 1mol 橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将①与②分别稀释相同倍数后溶液的pH:①>② | |
| B. | 若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3.NH3) | |
| C. | ③与④中已电离的水分子的数目相等 | |
| D. | ②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA | |
| B. | 常温常压下,18.00克重水(D2O)中所含电子数约为10NA | |
| C. | 在熔融状态下1molNaHSO4所含阳离子数为2NA | |
| D. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2、C2H4 | B. | C6H6,C6H6O | C. | C3H8,C3H6 | D. | CH2O、C2H4O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com