
����Ŀ��һ������ClO2����NaClO2������β�������Ĺ������£�
(1) д������Ӧ��������ClO2�Ļ�ѧ����ʽ��______________________________��
(2) ��β�����ա���Ϊ������δ��Ӧ��ClO2����������Ⱦ�⣬����_________________��
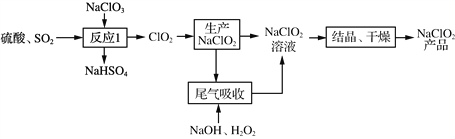
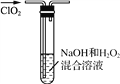
(3) ʵ��������ͼ��ʾװ��ģ�⡰β�����ա����̣������¶Ƚϵ�ʱ����Ч���ã����÷�ӦΪ���ȷ�Ӧ���ڲ��ı�����ҺŨ�Ⱥ�����������£���ʹ��Ӧ��0 �桫5 ���½��У�ʵ���пɲ�ȡ�Ĵ�ʩ��__________��_____________��
(4) Ϊ�˲ⶨ��ò�Ʒ��NaClO2�Ĵ��ȣ���������ʵ�飺
��ȷ��ȡ1.000 g������Ʒ������ˮ���100.00 mL����Һ��
��ȡ10.00 mL����Һ�����������KI��Һ�������������·������·�Ӧ��ClO��4I����4H��===2H2O��2I2��Cl�������ʲ���I����Ӧ��
����______��ָʾ�����ټ���0.2000 mol��L��1 Na2S2O3��Һ��ǡ����ȫ��Ӧʱ����Na2S2O3��Һ�����Ϊ20.00 mL��(��֪��I2��2S2O![]() ===2I����S4O
===2I����S4O![]() )���������Ʒ��NaClO2�Ĵ���_____��
)���������Ʒ��NaClO2�Ĵ���_____��
���𰸡� 2NaClO3��SO2��H2SO4===2ClO2��2NaHSO4 ����NaClO2�����NaClO2�IJ��ʻ����ClO2�������� ��װ�üӱ�ˮԡ ����ͨ��ClO2 ���� 90.50%
��������(1)NaClO3��SO2����������������������ԭ��Ӧ����ClO2��NaHSO4������Ӧ��������ClO2�Ļ�ѧ����ʽ��2NaClO3��SO2��H2SO4===2ClO2��2NaHSO4��(2) ��β�����ա���Ϊ������δ��Ӧ��ClO2����������Ⱦ�⣬��������NaClO2�����NaClO2�IJ��ʻ����ClO2�������� ��(3) �ڲ��ı�����ҺŨ�Ⱥ�����������£���ʹ��Ӧ��0 �桫5 ���½��У�ʵ���пɲ�ȡ�Ĵ�ʩ�и�װ�üӱ�ˮԡ�� ����ͨ��ClO2��(4)�۵��������۳���ɫ�����Ե�����ָʾ�����ɹ�ϵʽClO��2I2��4S2O![]() ��NaClO2�����ʵ���Ϊn��NaClO2��=
��NaClO2�����ʵ���Ϊn��NaClO2��=![]() =0.01mol,����Ʒ��NaClO2�Ĵ���=
=0.01mol,����Ʒ��NaClO2�Ĵ���=![]() =90.50%
=90.50%



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z�������壬ȡX��Y�����ʵ���֮��1��1��ϣ�����ij�ܱ������з�����ӦX+2Y![]() 2Z���ﵽƽ���û�������з�Ӧ��������ʵ�����������������ʵ���֮��Ϊ3��2����Y��ת������ӽ���
2Z���ﵽƽ���û�������з�Ӧ��������ʵ�����������������ʵ���֮��Ϊ3��2����Y��ת������ӽ���
A. 33% B. 40% C. 50% D. 65%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��G�����л���������ǵ�ת����ϵ���£� 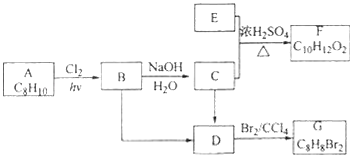
��ش��������⣺
��1����֪��6.0g������E��ȫȼ������8.8g CO2��3.6g H2O��E������������������ܶ�Ϊ30����E�ķ���ʽΪ ��
��2��AΪһȡ��������B�к���һ��������B����C�Ļ�ѧ����ʽΪ ��
��3����B����D����C����D�ķ�Ӧ�����ֱ����� ��
��4����A����B����D����G�ķ�Ӧ���ͷֱ����� ��
��5��F���������������У���ṹ��ʽΪ ��
��6����G��ͬ���칹���У�������һ�����IJ���ֻ��һ�ֵĹ����֣����к˴Ź�������������壬�ҷ������Ϊl��1��������ṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ�����ķ�ӦΪNa2SiO3+2HCl�T2NaCl+H2SiO3�����÷�Ӧ���ڣ�������
A.���Ϸ�Ӧ
B.�ֽⷴӦ
C.�û���Ӧ
D.���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ����������һ����ȷ����
A. 2.0gH218O��D2O�Ļ�����к���������ΪNA
B. 1.0L2.0mol/LNaOH��Һ�к�����ԭ����Ϊ2NA
C. 3.4gH2O2�μ�������ԭ��Ӧʱת�Ƶ�����Ϊ0.1 NA
D. ��״����2.24L��CCl4���й��ۼ���ĿΪ0.4 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧһѡ��3:���ʽṹ������]�ҹ������ƾõ���ʷ������������ʪ����ͭ(Fe+CuSO4=Cu+FeSO4),�Իش��������⡣
(1)Cu2+��δ�ɶԵ�������______����H��O��S�縺���ɴ�С��˳��Ϊ_______��
(2)������ͭ��Һ�еμӹ�����ˮ���γ�[Cu(NH3)4]SO4��ɫ��Һ��
��[Cu(NH3)4]SO4�л�ѧ��������_______��[Cu(NH3)4]2+�Ľṹ��ʽΪ_______������������ԭ���ӻ�����Ϊ______��
�ڰ��ķе�Զ�����(PH3)��ԭ����______________��
(3)��ͭ�Ͻ�������Ϊ_____�����ĵ���(I3)�͵���(I4)�����ֱܷ�Ϊ2957kJ/mol��5290kJ/mol���Ƚ����ݲ�����ԭ��________________��
(4)��ͭ�Ͻ��һ�־���ṹΪ�������ͣ���ͼ��ʾ��
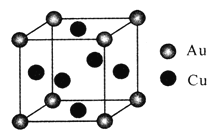
�ٸúϽ�Ļ�ѧʽΪ____��
����֪�úϽ���ܶ�Ϊdg/cm3,�����ӵ�����ֵΪNA��������ԭ�Ӽ���С��϶Ϊapm(1pm=10-10cm)����ͭԭ�ӵİ뾶Ϊ_______cm(д���������ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z���ֶ�����Ԫ�������ڱ��е�λ����ͼ��Xͨ���������Ե����γ�X2���ӣ�����˵������ȷ����

A. ������XZ3�и�ԭ�Ӿ�����8���ӵ��ȶ��ṹ
B. X��Y��Z����Ԫ���γɵĺ����ᶼ��ǿ��
C. �����£�Z���ʿ���Y���⻯����û���Ӧ
D. һ�������£�X2��Al��Ӧ�õ�AlX
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ����Ƶ�������ȷ���� �� ��
A. ���ڿ�����ȼ�գ�������ɫ����
B. ��¶���ڿ����У��������ɵ���ɫ��Na2O
C. �ƿ��Ա�����ú����
D. ����ˮ��Ӧ���������˵���Ƶ�Ӳ��С���۵�͡��ܶȱ�ˮС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�������ȡ�ⵥ�ʣ�����Ĺ����������£��ɺ��� ![]() ������
������ ![]() ����Һ
����Һ ![]() ��Һ
��Һ ![]() ��ˮ
��ˮ ![]() I2��CCl4
I2��CCl4
��Һ ![]() I2���й��ں�ˮ�Ƶ��˵����ȷ���ǣ� ��
I2���й��ں�ˮ�Ƶ��˵����ȷ���ǣ� ��
A.ʵ�����������������ոɺ����������ò���������
B.��I������Һ�м���ϡ�����˫��ˮ��Ԫ�ط�����ԭ��Ӧ
C.�ڵ�ˮ�м��뼸�ε�����Һ����Һ������ɫ����
D.��ˮ����CCl4�õ�I2��CCl4��Һ���ò���Ϊ��ȡ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com