
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜,镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)所得MnO2需充分洗涤,检验是否洗净的方法是________________________。
(2)上述流程脱硫实现了________________________(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(3)加入MnCO3是为了除去溶液中Fe3+和Al3+,检验Fe3+是否完全除掉的试剂为________________。
(4)加入KMnO4充分反应后,溶液酸性明显增强,写出反应的离子方程式______________________。
(5)假设脱除的SO2只与软锰矿浆中MrO2反应。按照图示流程,将a L(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为100%,最终得到MnO2的质量c g,则除去铁、铝、铜、镍等杂质以及外加KMnO4时,所引入的锰元素质量为多少g?_________________
【答案】 取最后一次洗涤液,癀加盐酸酸化的BaCl2溶液,若无沉淀生成,则表明已洗涤干净 A、C KSCN溶液(或硫氰化钾溶液) 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+ (![]() ×
×![]() -
-![]() )×55g
)×55g
【解析】
(1)所得MnO2 需充分洗涤,检验是否洗净的方法是: 取最后一次洗涤液,加盐酸酸化的BaCl2 溶液,若无沉淀生成,则表明已洗涤干净。
(2)因为燃煤尾气中的SO2会产生酸雨,对大气造成污染等,故工业上采用脱硫的方法减小污染,且将废气SO2转化为硫酸盐,使废气得到了综合利用,所以答案为A.C。
(3)加入MnCO3 是为了除去溶液中Fe3+和Al3+,因为Fe3+遇到硫氰化钾溶液显红色,所以检验Fe3+是否完全除掉的试剂为:为KSCN溶液。
(4)加入KMnO4充分反应后,溶液酸性明显增强,写出反应的离子方程式:2MnO4-+3Mn2++2H2O=5MnO2 ↓+4H+,
(5)实际参加反应的SO2的物质的量(a![]() b%)/22.4L,根据方程式MnO2(s)+SO2(g)=MnSO4(s)可知生成硫酸镁的物质的量是(a
b%)/22.4L,根据方程式MnO2(s)+SO2(g)=MnSO4(s)可知生成硫酸镁的物质的量是(a![]() b%)/22.4L,最终生成二氧化锰是ckg,则根据方程式3MnSO4+2KMnO4+2H2O=5MnO2+K2SO4+2H2SO4
b%)/22.4L,最终生成二氧化锰是ckg,则根据方程式3MnSO4+2KMnO4+2H2O=5MnO2+K2SO4+2H2SO4
3 5
x c/87
可知,消耗硫酸锰的物质的量是x=(3![]() c/87)/5mol,则除去铁、铝、铜、镍等杂质时,所引入的锰元素的物质的量是:
c/87)/5mol,则除去铁、铝、铜、镍等杂质时,所引入的锰元素的物质的量是: ![]() /22.4L,所引入的锰元素质量为(
/22.4L,所引入的锰元素质量为(![]() ×
×![]() -
-![]() )×55g
)×55g


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】杨梅醛是常用的水果型食用香精,其合成路线如下:
已知:(CH3CO)2O是乙酸酐,也可写成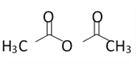 。
。
请回答下列问题:
(1)写出反应类型:①________;③________。
(2)写出反应②的化学方程式:_______________________。
(3)写出两种符合下列条件的![]() 的同分异构体:______。
的同分异构体:______。
i. 含有苯环 ii. 含有醛基:
(4)以下是检验ClCH2COOH中氯元素的实验方案,请把它补充完整。
取少量ClCH2COOH置于试管中,________,加热,_________________,滴加硝酸银溶液,观察是否产生白色沉淀。
(5)根据上述合成路线,设计以CH3COOH和![]() 为原料制备
为原料制备 的合成路线(其它试剂任选)_______。
的合成路线(其它试剂任选)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设一个氯原子的质量为ag,一个12C原子的质量为bg,用NA表示阿伏加德罗常数的值,则下列说法正确的是( )
A. 氯元素的相对原子质量为12/b
B. m g该氯原子的物质的量为m/(aNA) mol
C. 该氯原子的摩尔质量是aNA g
D. n g该氯原子所含的电子数是17n/a个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L HCl完全溶于水得到V mL盐酸,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是
①c=![]() ×100% ②c=
×100% ②c=![]() ③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
A. ①④ B. ②③
C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明浓HNO3的氧化性比浓H2SO4的氧化性强的事实是
A.浓硝酸加热能放出氧气
B.浓HNO3跟浓盐酸可配制成王水
C.HNO3跟金属反应可生成价态不同的氧化物
D.浓HNO3跟铜剧烈反应且不需加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液。下列说法不正确的是


A.甲中铜片作阴极,K+向铜片电极移动
B.乙中正极发生的电极反应为CO2+6e-+6H+![]() CH3OH+H2O
CH3OH+H2O
C.乙中H2SO4的作用是增强溶液的导电性
D.甲中若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. π键是由两个p轨道“头碰头”重叠形成的
B. σ键就是单键,π键就是双键
C. 乙烷分子中的键全为σ键,而乙烯分子中含σ键和π键
D. H2分子中含σ键,而Cl2分子中含π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③___________ | ④___________,有刺激性气体产生 |
⑤静置,___________ | ⑥___________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在__________中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至____________。
②滴定:取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72+6I+14H+![]() 3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32
3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32![]() S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
S4O62+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液__________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com