
| A. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{HCl(aq)}{→}$SiCl4 | |
| C. | Al2O3 $→_{△}^{NaOH(ap)}$ NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| D. | Fe2O3$\stackrel{H_{2}SO_{4}(aq)}{→}$Fe2(SO4)3(aq)$\stackrel{△}{→}$无水Fe2(SO4)3 |
分析 A.Ca(ClO)2溶液可与二氧化碳反应生成HClO,HClO在光照条件下分解生成氧气和HCl;
B.H2SiO3加热分解生成SiO2,SiO2与盐酸不反应;
C.氧化铝可与氢氧化钠溶液反应生成偏铝酸钠,通入二氧化碳可生成氢氧化铝;
D.Fe2O3与H2SO4反应生成Fe2(SO4)3,由于H2SO4是难挥发酸,Fe2(SO4)3加热分解生成无水Fe2(SO4)3.
解答 解:A.HClO的酸性比碳酸弱,Ca(ClO)2溶液可与二氧化碳反应生成HClO,HClO在光照条件下分解生成氧气和HCl,故A不选;
B.H2SiO3加热分解生成SiO2,SiO2与盐酸不反应,不能生成SiCl4,故B选;
C.氧化铝可与氢氧化钠溶液反应生成偏铝酸钠,通入二氧化碳可生成氢氧化铝,故C不选;
D.Fe2O3与H2SO4反应生成Fe2(SO4)3,由于H2SO4是难挥发酸,Fe2(SO4)3加热分解可以生成无水Fe2(SO4)3,故D不选,
故选B.
点评 本题考查化合物的性质,题目难度不大,熟练掌握物质的性质是解决此类问题的关键,正确运用物质分类及反应规律则是解决此类问题的有效方法.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Al3+、Cl-、OH- | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | K+、Na+、NO3-、HCO3- | D. | K+、NH4+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO)=1.5 mol•L-1•min-1 | B. | v(NO2)=0.7 mol•L-1•min-1 | ||
| C. | v(N2)=0.4 mol•L-1•min-1 | D. | v(CO2)=1.1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
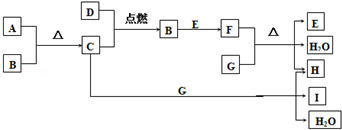
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
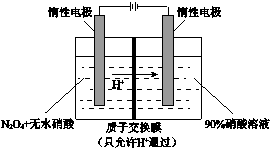 氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义.
氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①②③④ | B. | 仅②③④ | C. | 仅①③⑤ | D. | 仅②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com