
| A. | 参加反应的氧化剂与还原剂的物质的量之比为1:5 | |
| B. | 若有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol | |
| C. | 每生成1 mol Fe3O4,反应转移的电子为4 mol | |
| D. | O2是氧化剂,S2O32-与Fe2+是还原剂 |
分析 从电荷守恒的角度分析,可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,反应中3Fe2+→Fe3O4,当3molFe2+参加反应时,有2molFe2+化合价升高,反应中Fe和S元素的化合价升高,被氧化,O2为氧化剂,以此解答该题.
解答 解:A.参加反应的氧化剂与还原剂的物质的量之比为1:(2+2)=1:4,故A错误;
B.1molFe2+被氧化时,失去1mol电子,则被Fe2+还原的O2的物质的量为$\frac{1}{4}$mol,所以有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol,故B正确;
C.反应3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故C正确;
D.S2O32-→S4O62-,S元素的化合价升高,S2O32-和部分的Fe2+是还原剂,氧气是氧化剂,故D正确.
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子守恒计算的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A. | 绿原酸的分子式为C16H8O9 | |
| B. | 1mol绿原酸最多与7mol NaOH反应 | |
| C. | 绿原酸是芳香族化合物 | |
| D. | 绿原酸分子中有4种化学环境不同的氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 怀化市医疗机构临床检验结果报告单 | ||||
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌(Zn) | 115.92 | μmol/L | 66-120 |
| 2 | 铁(Fe) | 6.95↓ | mmol/L | 7.52-11.82 |
| 3 | 钙(Ca) | 1.68 | mmol/L | 1.55-2.10 |
| … | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小 | |
| B. | 用反应热数据的大小判断不同反应反应速率的快慢 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 用平衡常数的大小判断化学反应可能进行的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂化主要得到乙烯 | |
| B. | 石油分馏在分馏塔中进行,是化学变化,可得到汽油、煤油 | |
| C. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气等 | |
| D. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
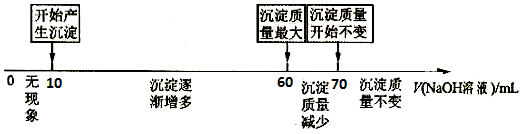
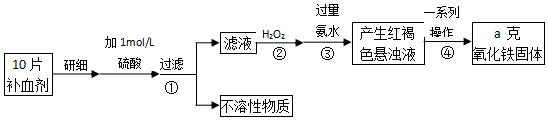
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 碱 | 盐 | |
| A | H2SO4 | NaOH | BaCO3 |
| B | H2S | K2CO3 | CuSO4 |
| C | NaHSO4 | NaOH | CaCl2 |
| D | HNO3 | KOH | Na2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用50mL量筒量取2.35mL稀硫酸 | |
| B. | 用托盘天平称5.56gKCl固体 | |
| C. | 配制100mlL浓度为1 mol/L的食盐水需称食盐5.9g | |
| D. | 用酒精可以萃取碘水中的碘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com