
| A. | 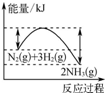 如图反应达到平衡后,升高温度,平衡向生成氨气的方向移动 | |
| B. | 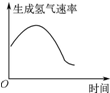 如图表示镁条放入盐酸中生成氢气的速率受温度和浓度的影响 | |
| C. | 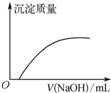 如图表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化 | |
| D. | 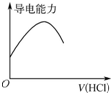 如图表示向氨水中通入HCl气体,溶液的导电能力变化 |
分析 A.根据图知,反应物总能量大于生成物总能量,该反应是放热反应,升高温度平衡向吸热方向移动;
B.氢离子浓度越大、溶液温度越高,化学反应速率越快;
C.向Ca(HCO3)2溶液中滴入NaOH溶液,立即生成碳酸钙沉淀;
D.溶液导电性与离子浓度成正比,一水合氨是弱电解质,氨水中离子浓度较小,HCl和一水合氨反应生成氯化铵,混合溶液中离子浓度增大,当无限通入氯化氢时,溶液中溶质为氯化铵和氯化氢,离子浓度增大.
解答 解:A.根据图知,反应物总能量大于生成物总能量,该反应是放热反应,升高温度平衡向吸热方向移动,即向逆反应方向移动,故A错误;
B.氢离子浓度越大、溶液温度越高,化学反应速率越快,该反应放热,开始一段时间内,离子浓度对化学反应速率影响小于温度对化学反应速率影响,所以反应速率增大,当离子浓度达到一定程度后,离子浓度对化学反应速率影响大于温度对化学反应速率影响,导致反应速率降低,故B正确;
C.向Ca(HCO3)2溶液中滴入NaOH溶液,立即生成碳酸钙沉淀,所以图象应该加入NaOH就生成沉淀,故C错误;
D.溶液导电性与离子浓度成正比,一水合氨是弱电解质,氨水中离子浓度较小,HCl和一水合氨反应生成氯化铵,混合溶液中离子浓度增大,当无限通入氯化氢时,溶液中溶质为氯化铵和氯化氢,离子浓度增大,所以溶液导电能力一直增大,故D错误;
故选B.
点评 本题考查较综合,涉及反应热图象分析、化学反应速率影响因素、离子反应、溶液导电性等知识点,侧重考查学生图象分析能力,明确化学反应原理及物质之间的转化是解本题关键,易错选项是D.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:多选题
| A. | 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| C. | 碳酸钙与稀盐酸反应:CaCO3+2H +=Ca2++H2O+CO2↑ | |
| D. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-+H++OH-=H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥⑦⑧ | B. | ①③⑦ | C. | ①③④⑤⑥⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丙烷 | B. | 1,3-丁二烯 | C. | 2-甲基丙炔 | D. | 2-甲基丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2F2的电子式: | |
| B. | 质子数为53、中子数为72的碘原子:${\;}_{53}^{125}$I | |
| C. | 16O的原子结构示意图: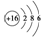 | |
| D. | 间羟基苯甲醛的结构简式: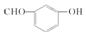 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com