
| A. | 溴化钠的电子式: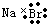 | B. | 硫原子的结构示意图: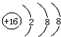 | ||
| C. | 氢气分子的电子式: | D. | 水的分子式为H2O |
分析 A、溴离子和钠离子间通过离子键形成溴化钠,阴阳离子需要标出电荷;
B、硫原子的核电荷数=核外电子总数=16,最外层为6个电子;
C、氢气为共价化合物,分子中存在1对共用电子对;
D、每个水分子中含有两个氢原子、1个氧原子.
解答 解:A、溴化钠为离子化合物,电子式中钠离子和溴离子需要标出所带电荷,溴化钠的电子式为: ,故A错误;
,故A错误;
B、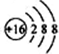 表示的是硫离子,硫原子的核外电子总数为16,硫原子的结构示意图为:
表示的是硫离子,硫原子的核外电子总数为16,硫原子的结构示意图为: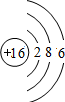 ,故B错误;
,故B错误;
C、氢气分子中存在2对共用电子对,氢气正确的电子式为:H:H,故C错误;
D、每个水分子中含有两个氢原子、1个氧原子,水的分子式为:H2O,故D正确;
故选ABC.
点评 本题考查了原子结构示意图、电子式、分子式的表示方法判断,题目难度中等,注意明确结构简式、分子式、结构式之间的关系及区别,明确离子化合物电子式与共价化合物的电子式的表示方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑤ | B. | 只有①②④ | C. | 只有②④ | D. | 只有①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 在 FeBr3的催化作用下可与溴水发生取代反应 | |
| B. | 该烃与足量 H2的加成产物一氯代物最多有四种 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 该烃是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中未成对电子最多的元素 |
| G的3d能级只含有2对成对电子 |
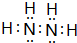 .
. 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com