【答案】
分析:A、B、C、D、E五种短周期元素,核电荷数依次增加,A的一种原子内无中子,则A为H;B原子最外层电子数是内层电子数的2倍,内层电子数为2,最外层电子数为4,则B为C;一个C
2-离子含10个电子,则C的质子数为10-2=8,所以C为O;A与D同族,D为Na;C与E同族,E为S.
(1)D与C形成一种含有两种化学键的离子化合物为过氧化钠;
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,含有-CHO,则甲为甲醛;
(3)一个分子含4个原子的为乙,为非极性分子,则乙为乙炔,根据燃烧热来书写热化学反应方程式;在碱性燃料电池中乙炔作负极,失去电子;
(4)均由A、C、D、E四种元素组成的两种物质丙和丁分别为NaHSO
4、NaHSO
3;
(5)碘离子被氧化为碘单质,遇淀粉变蓝,则A与C形成一种物质戊为H
2O
2;
(6)E的一种氧化物与ClO
-均具有漂白性,E的一种氧化物为SO
2,二者发生氧化还原反应.
解答:解:A、B、C、D、E五种短周期元素,核电荷数依次增加,A的一种原子内无中子,则A为H;B原子最外层电子数是内层电子数的2倍,内层电子数为2,最外层电子数为4,则B为C;一个C
2-离子含10个电子,则C的质子数为10-2=8,所以C为O;A与D同族,D为Na;C与E同族,E为S.
(1)D与C形成一种含有两种化学键的离子化合物为过氧化钠,其电子式为

,故答案为:
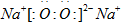
;
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,含有-CHO,则甲为甲醛,其结构式为
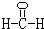
,故答案为:

;
(3)一个分子含4个原子的为乙,为非极性分子,则乙为乙炔,乙的燃烧热为1300kJ/mol,则热化学反应方程式为
C
2H
2(g)+

O
2(g)=2CO
2(g)+H
2O(1)△H=-1300kJ/mol,在碱性燃料电池中乙炔作负极,失去电子,电极反应为C
2H
2-10e
-+14OH
-=2CO
32-+8H
2O,
故答案为:C
2H
2(g)+

O
2(g)=2CO
2(g)+H
2O(1)△H=-1300kJ/mol;C
2H
2-10e
-+14OH
-=2CO
32-+8H
2O;
(4)均由A、C、D、E四种元素组成的两种物质丙和丁分别为NaHSO
4、NaHSO
3,
二者反应的离子反应为H
++HSO
3-=H
2O+SO
2↑,故答案为:H
++HSO
3-=H
2O+SO
2↑;
(5)碘离子被氧化为碘单质,遇淀粉变蓝,则A与C形成一种物质戊为H
2O
2,具有氧化性,二者发生氧化还原反应,离子反应为2I
-+H
2O
2+2H
+=I
2+2H
2O,
故答案为:2I
-+H
2O
2+2H
+=I
2+2H
2O;
(6)E的一种氧化物与ClO
-均具有漂白性,E的一种氧化物为SO
2,二者发生氧化还原反应,
离子反应为SO
2+ClO
-+H
2O=SO
42-+Cl
-+2H
+或SO
2+ClO
-+20H
-=SO
42-+Cl
-+H
2O,
故答案为:SO
2+ClO
-+H
2O=SO
42-+Cl
-+2H
+或SO
2+ClO
-+20H
-=SO
42-+Cl
-+H
2O.
点评:本题考查原子结构与元素周期律,元素的推断是解答本题的关键,熟悉化学用语及反应原理即可解答,(4)、(5)为学生解答的难点和易错点,题目难度中等.

 ,故答案为:
,故答案为: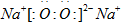 ;
;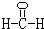 ,故答案为:
,故答案为: ;
; O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol,在碱性燃料电池中乙炔作负极,失去电子,电极反应为C2H2-10e-+14OH-=2CO32-+8H2O,
O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol,在碱性燃料电池中乙炔作负极,失去电子,电极反应为C2H2-10e-+14OH-=2CO32-+8H2O, O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol;C2H2-10e-+14OH-=2CO32-+8H2O;
O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol;C2H2-10e-+14OH-=2CO32-+8H2O;










