
Ti、Fe、Cr、Mn等均为过渡元素,在生产生活中起着不可替代的重要作用,对其单质和化合物的应用研究是目前科学研究的前沿之一.请回答下列问题:
(1)Cr元素(核电荷数为24)的基态原子电子排布式为 ,这一排布方式符合 (填原理或规则),比较Fe和 Mn的各级电离能后发现,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子 (填“难”或“易”).(每空两分,共6分)
(2)过渡元素有着与主族元素不同的价电子构型,其中外围电子构型为4f75d16s2的元素在周期表中处在 族,该族元素共有 种.
(3)某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应(巨磁电阻效应).用A、B、O表示这类特殊晶体的化学式: .
(4)有一种蓝色晶体可表示为:[KxFey(CN)z],研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,K+位于上述晶胞体心,且K+空缺率为50%(体心中没有K+的占总体心的百分比),其晶体中的阴离子晶胞结构如图2所示,该晶体的化学式可表示为
.
| 金刚石、二氧化硅等原子晶体的结构与性质的关系;晶胞的计算.. | |
| 专题: | 元素周期律与元素周期表专题;化学键与晶体结构. |
| 分析: | (1)根据能量最低原理及洪特规则特例书写;轨道上的电子处于全满、半满、全空时最稳定,电子不容易失去; (2)根据外围电子排布分析; (3)根据均摊法计算晶胞中A、B、O原子数目,进而确定化学式; (4)根据图2晶胞结构可知,晶胞中含有Fe2+的个数为4×=,Fe3+的个数为4×=、CN﹣的个数为12×=3,所以Fe2+、Fe3+、CN﹣的个数比为1:1:6,根据化合价代数和为零可知,x=1,则晶体的化学式可表示为KFe2(CN)6. |
| 解答: | 解:(1)根据能量最低原理及洪特规则特例,可知Cr元素基态原子电子排布式为1s22s22p63s23p63d54s1, 锰元素的3d能级和4s能级上的电子都是价电子,Mn元素基态原子的价电子排布式为3d54s2,由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转化为不稳定的3d4状态需要的能量较多;而Fe2+转化为Fe3+时,3d能级由不稳定的3d6转化为稳定的3d5半充满较稳定状态,需要的能量相对要少, 故答案为:1s22s22p63s23p63d54s1;能量最低原理及洪特规则;难; (2)根据外围电子构型为4f75d16s2,则元素在周期表中处在ⅢB族,该族元素共有32,故答案为:ⅢB;32; (3)晶胞中A原子数目=8×=1、B原子数目=1、O原子数目=6×=3,这类特殊晶体的化学式为:ABO3, 故答案为:ABO3; (4)根据图2晶胞结构可知,晶胞中含有Fe2+的个数为4×=,Fe3+的个数为4×=、CN﹣的个数为12×=3,所以Fe2+、Fe3+、CN﹣的个数比为1:1:6,根据化合价代数和为零可知,x=1,则晶体的化学式可表示为KFe2(CN)6,故答案为:KFe2(CN)6; |
| 点评: | 本题是对物质结构的考查,涉及核外电子排布、电离能、配位键、晶胞计算等,旨在考查学生对基础知识的掌握及综合应用,(1)中注意根据洪特规则特例进行理解分析,难度中等. |


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
有机物的结构可用“键线式”表示,如:CH3CH==CHCH3可简写为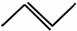 ,有机物X的键线式为
,有机物X的键线式为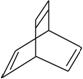 ,下列说法不正确的是(双选) ( )
,下列说法不正确的是(双选) ( )
A.X的化学式为C8H10
B.有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为 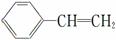
C.X能使酸性高锰酸钾溶液褪色
D.X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种物质在一定条件下反应,所得产物种类与反应物的用量或条件无关的是
①Fe + O2 ②Na2SiO3+CO2+ H2O ③NH4HCO3+NaOH
④Cu +Cl2 ⑤Ca(HCO3)2+Ca(OH)2 ⑥C+SiO2
A. ①②⑤ B.②③ C. ①⑤⑥ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
某结晶水合物的化学式为R•nH2O,其式量为M.25℃时,将ag该晶体溶于bg水中可形成VmL饱和溶液.下列关系中正确的是( )
|
| A. | 饱和溶液的物质的量浓度为c= |
|
| B. | 25℃时R的溶解度为S= |
|
| C. | 饱和溶液中溶质的质量分数为W= |
|
| D. | 饱和溶液的密度为ρ= |
查看答案和解析>>
科目:高中化学 来源: 题型:
分馏又称为分级蒸馏或精馏.适用于互溶而且沸点相差很小的多组分混合液的分离.控制好温度,便可将各种物质分离.有关分馏操作,下列说法正确的是( )
①液体量不超过烧瓶容积,不少于.
②温度计的水银球应位于蒸馏烧瓶支管口附近.
③为防止暴沸,应在烧瓶中加入沸石或碎瓷片.
④冷凝管中冷却水下进上出,先加热,再通水.
⑤按各组分沸点控制分馏温度,并收集在同一锥形瓶中
⑥停止加热后,应继续通水冷却冷凝管中蒸气.
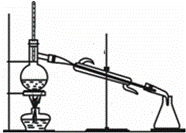
|
| A. | ①③④ | B. | ②③④ | C. | ③④⑤ | D. | ②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
MnO2是中学化学中常见的一种试剂,可作氧化剂和催化剂。某兴趣小组通过实验对MnO2
的性质进行了一系列的研究。
(1)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1 g·cm-3)配制浓度为3%的H2O2溶液(密度近似为1 g·cm-3)100 mL。简述其配制方法:______________________________。
(2)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是__________。
A.把MnO2固体加入到FeS O4溶液中,再加入KSCN溶液,观察溶液是否变血红
O4溶液中,再加入KSCN溶液,观察溶液是否变血红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变血红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2溶液,观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(3)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298 K,设计如下对比实验:
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2 mol·L-1 NaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1 mol·L-1硫酸 | 迅速变棕褐色 |
从上述对比实验中,可以得出的结论是_____________________________________。
写出在酸性条件下,MnO2氧化I-的离子方程式________________________________。
(4)利用二氧化锰的氧化性,让其与浓盐酸反应制取氯气,下列仪器可作为该反应的反应容器的是__________(填序号)。
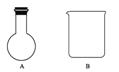
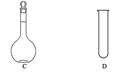
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机化合物A的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。下列叙述不正确的是( )
A.该化合物分子中含有4个氧原子
B.该化合物的相对分子质量是134
C.该化合物的化学式(分子式)是C5H10O4
D.该化合物分子中最多含2个 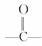 官能团
官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某有机物的球棍模型,下列关于该有机物的性质叙述中错误的是 ( )。
①能与HCl发生反应生成盐 ②能与NaOH发生反应生成盐
③能缩聚成高分子化合物 ④能发生消去反应 ⑤能发生水解反应 ⑥能使酸性高锰酸钾溶液褪色 
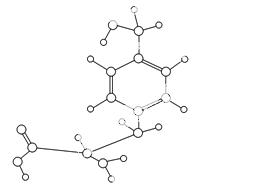
A.①② B.③⑥
C.①⑥ D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com