
为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入①适量的HCl②适量的NaCl③适量的氨水④适量的NaOH,正确的是( )
| A.①② | B.③ | C.③④ | D.④ |
B
解析试题分析:在溶液中NH4Cl=NH4++Cl-. 由于发生水解反应:NH4++ H2O NH3·H2O+ H+。所以c(Cl-)>c(NH4+)。为了使溶液中NH4+浓度与Cl-的浓度比为1:1,应该加入物质来抑制该水解反应的进行。①适量的HCl,平衡逆向移动,c(NH4+)增大,都是c(Cl-)也增大,所以仍然是c(Cl-)>c(NH4+)。错误。②适量的NaCl,由于溶液的稀释作用,NH4+水解程度增大,c(NH4+)减小,c(Cl-)增大,所以仍然是c(Cl-)>c(NH4+)。错误。③适量的氨水NH3·H2O电离产生NH4+,使c(NH4+)增大,Cl-则由于氨水的稀释作用c(Cl-)减小。因此可以形成NH4+浓度与Cl-的浓度比为1:1的溶液。正确。④适量的NaOH,OH-会消耗H+,使NH4+水解程度增大,c(NH4+)进一步减小,NH4+浓度与Cl-的浓度比比1:1更小。错误。
NH3·H2O+ H+。所以c(Cl-)>c(NH4+)。为了使溶液中NH4+浓度与Cl-的浓度比为1:1,应该加入物质来抑制该水解反应的进行。①适量的HCl,平衡逆向移动,c(NH4+)增大,都是c(Cl-)也增大,所以仍然是c(Cl-)>c(NH4+)。错误。②适量的NaCl,由于溶液的稀释作用,NH4+水解程度增大,c(NH4+)减小,c(Cl-)增大,所以仍然是c(Cl-)>c(NH4+)。错误。③适量的氨水NH3·H2O电离产生NH4+,使c(NH4+)增大,Cl-则由于氨水的稀释作用c(Cl-)减小。因此可以形成NH4+浓度与Cl-的浓度比为1:1的溶液。正确。④适量的NaOH,OH-会消耗H+,使NH4+水解程度增大,c(NH4+)进一步减小,NH4+浓度与Cl-的浓度比比1:1更小。错误。
考点:考查影响盐溶液中离子浓度的关系的知识。


科目:高中化学 来源: 题型:单选题
下列图示与对应的叙述相符的是
| A.图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B.向溶质为1mol的NaOH溶液中通入CO2,随着CO2气体的通入,溶液中水电离出的c(H+)有如上图2变化关系 |
| C.如上图2所示,水电离出c(H+)达到最大值时,溶液中各离子浓度大小分别为 c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)>c(H+) |
| D.用0.0l00mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂: HIn(aq)(红色)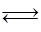 H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )
H+(aq)+In-(aq)(黄色)浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )
| A.①④⑤ | B.②⑤⑥ | C.①④ | D.②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,浓度均为0.1 mol/L 的下列四种盐溶液,其pH测定如下表所示:
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
| A.AgCl=AgI=Ag2S | B.AgCl<AgI< Ag2S |
| C.AgCl>AgI> Ag2S | D.AgI>AgCI> Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:下表为25 ℃时某些弱酸的电离平衡常数。图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |


 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:
①5 mL水
②20 mL 0.5 mol·L-1的Na2SO4溶液
③40 mL 0.2 mol·L-1的Ba(OH)2溶液
④40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是( )
| A.③>①>④>② | B.③>①>②>④ |
| C.①>④>③>② | D.①>③>④>② |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com