
 物质 物质T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |

 ΔH >0
ΔH >0| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
 CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。

科目:高中化学 来源:不详 题型:单选题
| A.将氢气、酒精设计成燃料电池,是因为燃料电池具有较高的能量利用率,同时氢气、酒精等燃料可再生 |
| B.大力开发丰富的煤炭资源,并将煤进行气化处理,提高煤的综合利用率,可减少对石油的依赖 |
| C.开发和利用太阳能、生物质能、风能等,如在我国西部和沿海地区兴建太阳能、风力发电站等 |
| D.合理开发利用海底可燃冰有助于缓解化石能源紧缺 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1 NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3

| A.NH4Cl | B.Na2CO3 | C.HOCH2CH2OH | D.HOCH2CH2NH2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 过程中的能量变化如图所示,下列说法错误的是
过程中的能量变化如图所示,下列说法错误的是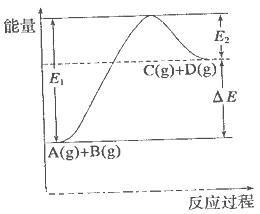
| A.该反应是吸热反应 |
| B.加入催化剂后,反应加快,A的转化率不变 |
| C.反应物的总键能小于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 钾 | 钠 | Na2CO3 | 金刚石 | 石墨 |
| 熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
| 沸点(℃) | 774 | 882.9 | 1850(分解产生CO2) | --- | 4250 |
 2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
2Na2CO3(1)+C(s,金刚石);△H=-1080.9kJ/mol
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),下列各数据表示同一反应速率是
2C(g),下列各数据表示同一反应速率是 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:| |温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 ΔH=+8.0kJ·mol-1
ΔH=+8.0kJ·mol-1 ΔH=+90.4kJ·mol-1
ΔH=+90.4kJ·mol-1 ΔH=-556.0kJ·mol-1
ΔH=-556.0kJ·mol-1 ΔH=-483.6kJ·mol-1
ΔH=-483.6kJ·mol-1 与
与 反应生成
反应生成 热化学方程式 。
热化学方程式 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
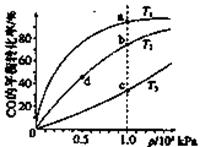
 CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,
CH3OH(g)的平衡常数如下表。按照相同的物质的量投料,| 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |
| K | 2.50 | 0.34 | 0.15 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com